Все соли растворимые вещества. Растворимость солей в воде при комнатной температуре
Лекция 3
Химическое равновесие. Закон действующих масс. Константа химического равновесия и способы ее выражения.
Химическое равновесие
В большинстве случаев химические реакции не протекают так глубоко, чтобы реагенты полностью превратились в продукты. Реакции идут до равновесия, при котором в системе имеются как продукты, так и непрореагировавшие исходные вещества, и не наблюдается дальнейшей тенденции к изменению их концентраций. Иногда количество продукта в равновесной смеси настолько превышает количество не вступивших в реакцию исходных веществ, что с практической точки зрения реакция завершается. Практически до конца доходят только такие реакции, при которых как минимум один из продуктов удаляется из сферы реакции (например, выпадает в осадок или выделяется из раствора в виде газа). Но во множестве важных случаев реакционная смесь при равновесии содержит значительные концентрации как продуктов, так и исходных веществ.
Химическое равновесие – это термодинамическое равновесие в системе, в которой возможны прямые и обратные химические реакции.
Существуют термодинамический и кинетический критерии химического равновесия. С кинетической точки зрения при химическом равновесии скорости всех реакций, идущих в двух противоположных направлениях, равны между собой, поэтому в системе не наблюдается изменения макроскопических параметров, в том числе концентраций реагирующих веществ.
С термодинамической точки зрения химическое равновесие характеризуется достижением минимального и не изменяющегося во времени значения энергии Гиббса (или энергии Гельмгольца).
Знание основных закономерностей учения о химическом равновесии совершенно необходимо химику-технологу. В промышленности, например, на химико-фармацевтических заводах, бесполезно строить сложные установки для получения тех или иных веществ, если термодинамические расчёты показывают, что реакция имеет тенденцию идти в “неправильном” направлении. Кроме того, при определении экономичности и рентабельности производства необходимо знать, как получить максимальный выход целевого продукта.
Подлинный механизм как прямой, так и обратной реакции во многих случаях сложен и часто в деталях или полностью не известен. К счастью для химиков, для того, чтобы получить правильные выводы о протекании химических процессов, нет необходимости знать настоящий механизм реакции.
Предсказание направления химической реакции, а также вычисление теоретического равновесного выхода её продуктов и состава равновесной реакционной смеси в зависимости от исходного состава, температуры и давления и является главной задачей учения о химическом равновесии.
Константа равновесия
Произвольную обратимую химическую реакцию можно описать уравнением вида:
aA + bB Û dD + eE
В соответствии с законом действующих масс в простейшем случае скорость прямой реакции связана с концентрациями исходных веществ уравнением
vпр = k пр С Аа С Вb,
а скорость обратной реакции - с концентрациями продуктов уравнением
vобр = kобр С Dd С Ee .
При достижении равновесия эти скорости равны друг другу:
vпр = vобр
Отношение друг к другу констант скорости прямой и обратной реакций будет равно константе равновесия :
Так как это выражение основано на учёте количества реагентов и продуктов реакции, оно является математической записью закона действующих масс для обратимых реакций .
Константа равновесия, выраженная через концентрации реагирующих веществ, называется концентрационной и обозначается Кс . Для более строгого рассмотрения следует вместо концентраций использовать термодинамические активности веществ а = fC (где f - коэффициент активности). При этом речь идёт о так называемой термодинамической константе равновесия
При малых концентрациях, когда коэффициенты активности исходных веществ и продуктов близки к единице, Кс и Ка практически равны друг другу.
Константа равновесия реакции, протекающей в газовой фазе, может быть выражена через парциальные давления р веществ, участвующих в реакции:
Между Кр и Кс существует соотношение, которое можно вывести таким образом. Выразим парциальные давления веществ через их концентрации с помощью уравнения Менделеева - Клапейрона:
pV = nRT ,
откуда p = (n /V )RT = CRT .
Тогда для реакции в общем виде после замены парциальных давлений на концентрации получим
Заменяя выражение (d + с) - (а + b) на равное ему D n , получим окончательное выражение
Кр = Кс (RT )D n или Кс = Кр (RT )-D n ,
где D n - изменение числа молей газообразных веществ в ходе реакции:
D n = å ni прод (г) - å ni исх (г) ).
Если D n = 0, т. е. процесс идёт без изменения числа молей газообразных веществ, и Кр = Кс .
Например, для реакции гидратации этилена, протекающей в газовой фазе:
C2H4 (г) + H2O (г) Û C2H5OH (г),
В данном случае D n = 1 - (1 + 1) = -1. Значит, соотношение между константами может быть выражено таким уравнением:
Кр = Кс (RT )- 1 или Кс = Кр RT .
Таким образом, зная Кр этой реакции при каждой данной температуре, можно вычислить значение Кс и наоборот.
Расчёты с применением констант равновесия
Константы равновесия используются главным образом для получения ответов на следующие вопросы:
1. Должна ли самопроизвольно протекать реакция при определённых условиях?
2. Какова будет концентрация продуктов (равновесный выход) после установления в системе равновесия?
Определение направления протекания обратимых реакций
Так как константа равновесия представляет собой отношение констант скорости прямой и обратной реакций, то само её значение говорит о направлении процесса. Так, если константа равновесия больше единицы, то при данных условиях самопроизвольно будет осуществляться прямая реакция, если же она меньше единицы - обратная реакция.
В соответствии с принципом Ле-Шателье положение равновесия может быть смещено при изменении условий, в которых протекает реакция. Поэтому в общем случае можно оценить смещение равновесия при изменении соотношения начальных количеств веществ, участвующих в реакции. Если соотношение концентраций реагирующих веществ в начальный момент обозначить P :
то по соотношению Z и Кс можно предсказать направление реакции при заданных условиях эксперимента:
при P < K самопроизвольно протекает прямая реакция;
при P > K самопроизвольно протекает обратная реакция;
при P = K система находится в равновесии.
Чем больше значение константы равновесия отличается от единицы, тем в большей степени равновесие реакции сдвинуто в соответствующую сторону (вправо при К > 1 и влево при К < 1).
Факторы, влияющие на равновесие. Принцип Ле-Шателье -
Брауна
При равновесии прямая и обратная реакции точно компенсируют друг друга. Но насколько чувствительна эта компенсация к изменениям условий реакций? Каким способом можно изменить состояние равновесия? Эти вопросы имеют большое практическое значение, если требуется повысить выход полезного продукта реакции, например, лекарственного вещества, или, наоборот, уменьшить выход нежелательного продукта.
Если имеется возможность непрерывно выводить продукты из реакционной смеси (раствора) в виде газа или осадка, а также с помощью таких технологических операций, как вымораживание, вымывание и пр., то тем самым реагирующая система может постоянно удерживаться в неравновесном, несбалансированном состоянии. В этих условиях возникает необходимость во все новых количествах реагентов и происходит непрерывное образование продуктов. Такой способ нарушения равновесия в сторону получения желаемого продукта осуществляется без изменения константы равновесия. Но часто можно повысить выход продуктов, увеличивая константу равновесия.
Один из способов увеличения константы равновесия - изменение температуры . Так как в большинстве случаев скорости прямой и обратной реакции зависят от Т , константа равновесия тоже проявляет зависимость от температуры. Строго говоря, изменение температуры одновременно изменяет скорость и прямой, и обратной реакции. Но, если повышение температуры ускоряет прямую реакцию в большей степени, чем обратную, то константа равновесия при этом увеличится.
Температурная зависимость положения равновесия является одним из примеров общего принципа подвижного химического равновесия, называемого принципом Ле-Шателье (или Ле-Шателье - Брауна):
Если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, положение равновесия смещается в такую сторону, чтобы противодействовать эффекту этого воздействия .
Принцип Ле-Шателье относится и к другим способам воздействия на равновесие, например, к изменению давления, но он имеет качественный характер. Количественно зависимость константы равновесия реакции от различных факторов выражается уравнениями изотермы, изобары и изохоры химической реакции, выведенными Я. Вант-Гоффом.
Влияние на равновесие начального состава реакционной
смеси. Уравнение изотермы химической реакции
Максимальная работа реакции, идущей в газовой фазе при постоянных температуре и давлении, является алгебраической суммой работ, совершённых всеми участвующими в реакции веществами при переходе от начальных парциальных давлений к равновесным.
Рассмотрим газовую реакцию, выражаемую в общем виде уравнением
aA + bB Û dD + eE.
Давление р в системе с помощью уравнения Менделеева - Клапейрона может быть выражено через объём V и температуру T :
p = nRT /V ,
откуда, принимая, что суммарное число молей всех компонентов равно 1, получаем для работы расширения
pdV = (RT /V )dV ,
Так как максимальная полезная работа может быть вычислена при интегрировании выражения: V2
А’max = ò pdV ,
получаем
а так как А’max = -D Gr ,
то можно записать:
Для процессов, идущих при постоянном объёме, можно получить аналогичные выражения, в которые входит максимальная работа и изменение энергии Гельмгольца в ходе реакции. При этом парциальные давления заменяются начальными концентрациями веществ:
Уравнения (4.1) - (4.4), выведенные Я. Вант-Гоффом, называются уравнениями изотермы химической реакции . Они дают возможность определить, в каком направлении и до какого предела может протекать реакция в рассматриваемых условиях при заданном составе реакционной смеси при постоянной температуре.
Для стандартных условий, когда исходные парциальные давления (или исходные концентрации или активности) всех веществ-участников реакции равны единице, уравнения изотермы будут выглядеть так:
А ’max = RT ln Kp ; D Gor = - RT ln Kp (4.5)
А max = RT ln K с ; D А o r = - RT ln K с .
Отсюда следует, что определяя стандартную величину D Gor или D А o r для реакции, можно легко вычислить её константу равновесия.
Влияние на равновесный выход изменения объёма
и давления реакционной смеси
Для реакций, идущих в газовой фазе, об изменении объёма реакционной смеси можно судить по изменению числа молей реагирующих веществ
D n = å ni прод - å ni исх
Возможны три случая, соответствующих различным типам химических реакций:
а) D n < 0 (реакция идет с уменьшением объёма). Например, реакция синтеза аммиака :
N2 (г) + 3H2 (г) Û 2NH3 (г) ; D n = 2 - (1 + 3) = -2
В соответствии с принципом Ле-Шателье уменьшение объёма (при увеличении давления) будет сдвигать равновесие этой и подобных реакций вправо, а увеличение объёма (при уменьшении давления) - влево.
б) D n > 0 (реакция идет с увеличением объёма). Например, реакция разложения метанола:
CH3OH (г) Û CO (г) + 2H2 (г) ; D n = (1 + 2) - 1 = 2
В этом случае уменьшение объёма (или увеличение давления) будет сдвигать равновесие влево, а увеличение объёма (при уменьшении давления) - вправо.
в) D n = 0 (реакция идет без изменения объёма). Например, реакция хлора с бромоводородом:
Cl2 (г) + 2HBr (г) Û Br2 (г) + 2HCl (г) ; D n = (1 + 2) - (1 + 2) = 0
На выходе продуктов таких реакций изменение объёма (давления) реакционной смеси не сказывается.
Химическое равновесие в гетерогенных системах
Рассмотренные ранее закономерности относятся, главным образом, к гомогенным реакциям, т. е. к реакциям с участием веществ, находящихся в одном физическом состоянии - в виде газа или в виде раствора. Равновесия, в которых принимают участие вещества, находящиеся в двух или нескольких физических состояниях (например, газ с жидкостью или с твёрдым веществом), называются гетерогенными равновесиями.
В качестве примера рассмотрим разложение карбоната кальция CaCO3, используемого в фармации в качестве антацидного средства (сниж кислотность). Это удобная модель для рассмотрения разложения различных твёрдых веществ, в том числе и лекарственных, идущего с образованием газообразных продуктов:
CaCO3 (т) Û CaO (т) + CO2 (г)
В соответствии с законом действующих масс выражение для константы равновесия этой реакции можно написать так:
Парциальные давления CaO и CaCO3 в газовой фазе, во-первых, очень малы, а во-вторых, остаются практически постоянными в любой момент протекания реакции. Это значит, что пока твёрдые CaCO3 и CaO находятся в контакте с газом, их влияние на равновесие будет неизменным. В этом случае константа равновесия не зависит от количества твёрдой фазы. Можно разделить обе части выражения для константы равновесия на величину p CaO/p CaCO3 и принять, что
K ’ p = p CO2 ,
где K ’ p = Kp p CaC03/p CaO - модифицированная константа равновесия; при этом парциальные давления CaCO3 и CaO входят в величину K ’ p в неявном виде.
Если парциальное давление СО2 над CaCO3, при данной температуре поддерживается меньшим, чем значение K ’ p , то весь CaCO3 превратится в CaO и CO2; если же парциальное давление p CO2 больше, чем K ’ p , то весь СaO превратится в CaCO3. Равновесное же парциальное давление CO2, равное K ’ p при данной температуре, называется давлением диссоциации .
При достижении давления СО2 1 атм равновесие в данной реакции сдвигается в сторону диссоциации СаСО3, т. е. разложения карбоната кальция. это происходит при температуре 897оС:
Подобные рассуждения и понятие давления диссоциации могут быть распространены и на другие гетерогенные реакции с участием твёрдых веществ. В том случае, когда лекарственное вещество (в порошке или в таблетках) может реагировать с газами, находящимися в воздухе (H2O, O2, CO2), или разлагаться с их выделением, необходимо следить, чтобы парциальное давление этих газов и паров в атмосфере склада было меньше, чем давление диссоциации (или соответствующая константа равновесия K ’ p ).
Произвольную обратимую химическую реакцию можно описать уравнением вида:
aA + bB Û dD + eE
В соответствии с законом действующих массв простейшем случае скорость прямой реакции связана с концентрациями исходных веществ уравнением
v пр = k пр С А а С В b ,
а скорость обратной реакции - с концентрациями продуктов уравнением
v обр = k обр С D d С E e .
При достижении равновесия эти скорости равны друг другу:
v пр = v обр
Отношение друг к другу констант скорости прямой и обратной реакций будет равно константе равновесия :
Так как это выражение основано на учёте количества реагентов и продуктов реакции, оно является математической записью закона действующих масс для обратимых реакций .
Константа равновесия, выраженная через концентрации реагирующих веществ, называется концентрационнойи обозначается К с . Для более строгого рассмотрения следует вместо концентраций использовать термодинамические активностивеществ а = fC (где f - коэффициент активности). При этом речь идёт о так называемой термодинамической константе равновесия
При малых концентрациях, когда коэффициенты активности исходных веществ и продуктов близки к единице, К с и К а практически равны друг другу.
Константа равновесия реакции, протекающей в газовой фазе, может быть выражена через парциальные давления р веществ, участвующих в реакции:
Между К р и К с существует соотношение, которое можно вывести таким образом. Выразим парциальные давления веществ через их концентрации с помощью уравнения Менделеева - Клапейрона:
pV = nRT ,
откуда p = (n /V )RT = CRT .
Тогда для реакции в общем виде после замены парциальных давлений на концентрации получим
Заменяя выражение (d + с) - (а + b) на равное ему Dn , получим окончательное выражение
К р = К с (RT ) D n или К с = К р (RT ) - D n ,
где Dn - изменение числа молей газообразных веществ в ходе реакции:
Dn = ån i прод (г) - ån i исх (г) ).
Если Dn = 0, т. е. процесс идёт без изменения числа молей газообразных веществ, и К р = К с .
Например, для реакции гидратации этилена, протекающей в газовой фазе:
C 2 H 4 (г) + H 2 O (г) Û C 2 H 5 OH (г) ,
В данном случае Dn = 1 - (1 + 1) = -1. Значит, соотношение между константами может быть выражено таким уравнением:
К р = К с (RT ) - 1 или К с = К р RT .
Таким образом, зная К р этой реакции при каждой данной температуре, можно вычислить значение К с и наоборот.
Размерность констант равновесия зависит от способа выражения концентрации (давления) и стехиометрии реакции. Часто она может вызывать недоумение, например, в рассмотренном примере [моль - 1 м 3 ] для К с и [Па - 1 ] для К р , но в этом нет ничего неверного. При равенстве сумм стехиометрических коэффициентов продуктов и исходных веществ константа равновесия будет безразмерной.
В 1885 году французским физиком и химиком Ле Шателье был выведен, а в 1887 году немецким физиком Брауном обоснован закон химического равновесия и константа химического равновесия, а также изучена их зависимость от влияния различных внешних факторов.
Суть химического равновесия
Равновесие - состояние, означающее, что вещи всегда движутся. Продукты разлагаются на реактивы, а реактивы объединяются в продукты. Вещи движутся, но концентрации остаются неизменными. Реакция записывается с двойной стрелкой вместо знака равенства, чтобы показать, что она обратима.

Классические закономерности
Еще в прошлом веке химиками были открыты определенные закономерности, которые предусматривают вероятность изменения направления реакции в одной и той же емкости. Знания о том, как протекают химические реакции, невероятно важны, как для лабораторных исследований, так и промышленного производства. При этом большое значение имеет возможность контролировать все эти явления. Человеку свойственно вмешиваться во многие природные процессы, в особенности это касается обратимых, чтобы потом использовать их себе на благо. От знаний о химических реакциях будет больше пользы, если в совершенстве владеть рычагами управления ими.
Закон действующих масс в химии использую химики, чтобы правильно рассчитывать скорости протекания реакций. Он дает четкое представление о том, что ни один не будет доведен до конца в случае, если он будет проходить в системе закрытого типа. Молекулы образующихся веществ находятся в постоянном и беспорядочном движении, и может вскоре возникнуть обратная реакция, при которой будут восстанавливаться молекулы исходного материала.
В промышленности чаще всего используют открытые системы. Сосуды, аппараты и другие емкости, где проходят химические реакции, остаются незапертыми. Это необходимо для того, чтобы во время этих процессов можно было извлечь нужный продукт и избавиться от бесполезных продуктов реакции. Например, уголь сжигается в открытых топках, цемент производится в печах открытого типа, домны функционируют при постоянной подаче воздуха, а аммиак синтезируется при непрерывном удалении самого аммиака.

Обратимые и необратимые химические реакции
Исходя из названия, можно дать соответствующие определения: необратимыми считаются реакции, доводимые до конца, не изменяющие своего направления и протекающие по заданной траектории вне зависимости от перепадов давления и температурных колебаний. Их отличительной особенностью является то, что некоторые продукты могут покидать сферу реакции. Таким образом, например, можно получить газ (CaCO 3 = CaO + CO 2), осадок (Cu(NO 3) 2 + H 2 S = CuS + 2HNO 3) или другие также будет считаться необратимой, если во время процесса выделяется большое количество тепловой энергии, например: 4P + 5O 2 = 2P 2 O 5 + Q.
Практически все реакции, которые происходят в природе, являются обратимыми. Независимо от таких внешних условий, как давление и температура, практически все процессы могут протекать одновременно в разных направлениях. Как гласит закон действующих масс в химии, количество поглощенной теплоты будет равно количеству выделенной, это значит, что если одна реакция была экзотермической, то вторая (обратная) буде эндотермической.
Химическое равновесие: константа химического равновесия
Реакции - это «глаголы» химии - деятельность, которую изучают химики. Многие реакции переходят к их завершению, а затем останавливаются, а это означает, что реагенты полностью преобразуются в продукты, не имея возможности вернуться в исходное состояние. В некоторых случаях реакция действительно необратима, например, когда сжигание изменяет как физические, так и химические Однако существует множество других обстоятельств, в которых является не только возможной, но и непрерывной, так как продукты первой реакции становятся реагентами во второй.
Динамическое состояние, в котором концентрации реагентов и продуктов остаются постоянными, называется равновесием. Можно предсказать поведение веществ с помощью определенных законов, которые применяются в отраслях, стремящихся снизить издержки производства конкретных химических веществ. Для понимания процессов, которые сохраняют или потенциально угрожают здоровью людей, также полезным является понятие химического равновесия. Константа химического равновесия представляет собой значение фактора реакции, которое зависит от ионной силы и температуры, и не зависит от концентраций реагентов и продуктов в растворе.

Вычисление константы равновесия
Эта величина является безразмерной, то есть не имеющей определенного количества единиц. Хотя расчет обычно записывается для двух реагентов и двух продуктов, он работает для любого количества участников реакции. Расчет и интерпретация константы равновесия зависят от того, связана ли химическая реакция с однородным или гетерогенным равновесием. Это значит, что все вступающие в реакцию компоненты могут быть чистыми жидкостями или газами. Для реакций, которые достигают гетерогенного равновесия, присутствует, как правило, не одна фаза, а как минимум две. Например, жидкости и газы или и жидкости.

Значение константы равновесия
Для любой заданной температуры для константы равновесия существует только одно значение, которое изменяется только в том случае, если температура, при которой происходит реакция, изменяется в ту или иную сторону. Можно сделать некоторые прогнозы относительно химической реакции, исходя из того, является ли постоянная равновесия большой или малой. Если значение очень велико, то равновесие благоприятствует реакции вправо и получается больше продуктов, чем было реагентов. Реакцию в этом случае можно назвать «полной» или «количественной».
Если значение константы равновесия невелико, то оно благоприятствует реакции влево, где количество реагентов было больше, чем образовавшихся продуктов. Если это значение стремится к нулю, можно считать, что реакция не возникает. Если же значения константы равновесия для прямой и обратной реакции почти одинаковы, то количество реагентов и продуктов будет тоже почти одинаковым. Этот тип реакции считается обратимым.

Рассмотрим конкретную обратимую реакцию
Возьмем таких два химических элемента, как йод и водород, которые при смешивании дают новое вещество - иодоводород.
За v 1 примем скорость прямой реакции, за v 2 - скорость обратной реакции, k - константа равновесия. Используя закон действия масс, получаем следующее выражение:
v 1 = k 1 * c(H 2) * c(I 2),
v 2 = k 2 * c 2 (HI).
При смешивании молекул йода (I 2) и водорода (H 2) начинается их взаимодействие. На начальном этапе концентрация этих элементов максимальная, а вот к концу реакции максимальной будет концентрация нового соединения - иодоводорода (HI). Соответственно, разными будут и скорости реакций. В самом начале они будут максимальными. Со временем наступает момент, когда эти значения будут равными, он и является состоянием, которое называется химическим равновесием.
Выражение константы химического равновесия, как правило, обозначают с применением квадратных скобок: , , . Так как при состоянии равновесия скорости равны, то:
k 1 = k 2 2 ,
так получаем уравнение константы химического равновесия:
k 1 /k 2 = 2 / = K.

Принцип Ле Шателье-Брауна
Существует следующая закономерность: если на систему, которая находится в равновесии, произвести определенное воздействие (изменить условия химического равновесия путем изменения температуры или давления, например), то баланс будет смещаться, чтобы частично противодействовать эффекту изменения. В дополнение к химии этот принцип также применим в несколько разных формах к областям фармакологии и экономики.

Константа химического равновесия и способы ее выражения
Равновесное выражение может быть выражено в терминах концентрации продуктов и реагентов. Только химические вещества в водной и газообразной фазах включены в равновесную формулу, поскольку концентрации жидкостей и твердых веществ не изменяются. Какие факторы влияют на химическое равновесие? Если в нем участвует чистая жидкость или твердое вещество, считается, что оно имеет К= 1, и соответственно перестает браться в расчет, за исключением высококонцентрированных растворов. Например, чистая вода имеет активность 1.
Другим примером является твердый углерод, который может образовываться реакцией двух молекул монооксида карбона с образованием углекислого газа и углерода. Факторы, которые могут повлиять на равновесие, включают в себя добавление реагента или продукта (изменение концентрации влияет на баланс). Добавление реагента может привести к равновесию справа в химическом уравнении, где появляется больше форм продукта. Добавление продукта может привести к равновесию слева, так как больше становится форм реагентов.

Равновесие возникает, когда реакция, проходящая в обоих направлениях, имеет неизменное соотношение продуктов и реагентов. В целом, химическое равновесие статично, так как количественное соотношение продуктов и реагентов постоянны. Однако более пристальный взгляд показывает, что равновесие на самом деле является очень динамичным процессом, так как реакция движется в обоих направлениях в равном темпе.
Динамическое равновесие является примером функции устойчивого состояния. Для системы в устойчивом состоянии наблюдаемое в настоящее время поведение продолжается и в будущем. Поэтому, как только реакция достигнет равновесия, отношение концентраций продукта и реагента останется таким же, хотя реакция продолжается.

Как просто рассказать о сложном?
Такие понятия, как химическое равновесие и константа химического равновесия, являются достаточно сложными для понимания. Возьмем пример из жизни. Вы когда-нибудь застревали на мосту между двумя городами и обращали внимание на то, что движение в другом направлении плавное и размеренное, в то время как вы безнадежно застряли в пробке? Это нехорошо.
Что, если бы машины размеренно и с одинаковой скоростью двигались с обеих сторон? Оставалось бы количество автомобилей в обоих городах постоянным? Когда скорость въезда и выезда в оба города одинакова, а количество автомобилей в каждом городе стабильно с течением времени, это означает, что весь процесс находится в динамическом равновесии.
K p = ∏ p i ν i {\displaystyle K_{p}=\prod p_{i}^{{\nu }_{i}}}
Например, для реакции окисления монооксида углерода :
2CO + O 2 = 2CO 2
константа равновесия может быть рассчитана по уравнению:
K p = p C O 2 2 p C O 2 ⋅ p O 2 {\displaystyle K_{p}={\frac {p_{CO_{2}}^{2}}{p_{CO}^{2}\cdot p_{O_{2}}}}} K p = K x P Δ n {\displaystyle K_{p}=K_{x}P^{\Delta n}}где Δn - изменение числа молей веществ в ходе реакции. Видно, что K x зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ ( Δ n = 0 {\displaystyle \Delta n=0} ), то K p = K x {\displaystyle K_{p}=K_{x}} .
Стандартная константа равновесия
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
K 0 = ∏ (p i ~) v i {\displaystyle K^{0}=\prod ({\tilde {p_{i}}})^{v_{i}}} где p i ~ {\displaystyle {\tilde {p_{i}}}} - относительные парциальные давления компонентов, p i ~ = p i / p i 0 {\displaystyle {\tilde {p_{i}}}=p_{i}/p_{i}^{0}} .Стандартная константа равновесия - безразмерная величина. Она связана с K p соотношением:
K p = K 0 (p i 0) Δ n {\displaystyle K_{p}=K^{0}(p_{i}^{0})^{\Delta n}}Видно, что если p i 0 {\displaystyle p_{i}^{0}} выражены в атмосферах, то (p i 0) Δ n = 1 {\displaystyle (p_{i}^{0})^{\Delta n}=1} и K p = K 0 {\displaystyle K_{p}=K^{0}} .
Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям f i 0 = p i 0 {\displaystyle f_{i}^{0}=p_{i}^{0}} = 0,1013 МПа или 1 атм. K f связана с K 0 соотношением:
K f = K 0 (γ i p i 0) Δ n {\displaystyle K_{f}=K^{0}(\gamma _{i}p_{i}^{0})^{\Delta n}} где γ i - коэффициент фугитивности i-го реального газа в смеси.Константа равновесия реакций в гетерогенных системах
FeO т + CO г = Fe т + CO 2гконстанта равновесия (при условии, что газовая фаза идеальна) имеет вид:
K p = p C O 2 p C O {\displaystyle K_{p}={\frac {p_{CO_{2}}}{p_{CO}}}}Термодинамическое описание равновесия
Наряду с обозначением Q для соотношения активностей веществ в произвольный момент реакции t ("коэффициент реакции ")
Q r = { S t } σ { T t } τ { A t } α { B t } β = ∏ a j (t) ν j ∏ a i (t) ν i = ∏ a n (t) ν n {\displaystyle Q_{r}={\frac {\left\{S_{t}\right\}^{\sigma }\left\{T_{t}\right\}^{\tau }}{\left\{A_{t}\right\}^{\alpha }\left\{B_{t}\right\}^{\beta }}}={\frac {\prod a_{j(t)}^{\nu _{j}}}{\prod a_{i(t)}^{\nu _{i}}}}=\prod a_{n(t)}^{\nu _{n}}} (обозначения для приведённой ниже реакции; последнее равенство написано в обозначении, что стехиометрические коэффициент берутся со знаком "+" для продуктов и со знаком "-" для исходных веществ)в химической термодинамике используется обозначение K eq для такого же по форме соотношения между равновесными активностями веществ
K e q = [ S ] σ [ T ] τ [ A ] α [ B ] β = ∏ a j (t = ∞) ν j ∏ a i (t = ∞) ν i = ∏ a n (t = ∞) ν n {\displaystyle K_{eq}={\frac {[S]^{\sigma }[T]^{\tau }}{[A]^{\alpha }[B]^{\beta }}}={\frac {\prod a_{j(t=\infty)}^{\nu _{j}}}{\prod a_{i(t=\infty)}^{\nu _{i}}}}=\prod a_{n(t=\infty)}^{\nu _{n}}} (то есть соотношения активностей в момент t = ∞ {\displaystyle t=\infty } , в момент равновесия). Далее приведено термодинамическое описание химического равновесия и описана связь K eq со стандартной энергией Гиббса процесса.В системе, где протекает химическая реакция
α A + β B ⇌ σ S + τ T {\displaystyle \alpha A+\beta B\rightleftharpoons \sigma S+\tau T}равновесие может быть описано условием
(d G d ξ) T , p = 0 {\displaystyle \left({\frac {dG}{d\xi }}\right)_{T,p}=0} где ξ {\displaystyle \xi } есть химическая переменнаяили, то же самое условие равновесия может быть записано с использованием химических потенциалов как
α μ A + β μ B = σ μ S + τ μ T {\displaystyle \alpha \mu _{A}+\beta \mu _{B}=\sigma \mu _{S}+\tau \mu _{T}}где химические потенциалы
μ A = μ A ⊖ + R T ln { A } {\displaystyle \mu _{A}=\mu _{A}^{\ominus }+RT\ln\{A\}} здесь {A} - строго говоря, активность реагента A; при допущениях об идеальных газах можно заменить их на давления, для реальных газов можно заменить на фугитивности, при допущении о том, что раствор подчиняется закону Генри , можно заменить на мольные доли , и при допущении, что раствор подчиняется закону Рауля - на парциальные давления ; для системы в равновесии может быть заменена на равновесную молярную концентрацию или на равновесную активность. Δ r G o = − R T ln K e q {\displaystyle \Delta _{r}G^{o}=-RT\ln K_{eq}}Равновесный состав смеси и направление реакции
Упомянутый выше "коэффициент реакции" Q (другие обозначения, встречающиеся в литературе - Ω {\displaystyle \Omega } или π {\displaystyle \pi } , "произведение реакции")
Q r = ∏ a n (t) ν n {\displaystyle Q_{r}=\prod a_{n(t)}^{\nu _{n}}}отражает соотношение текущих активностей всех участников реакции и может быть использован для определения направления реакции в момент, для которого известен Q
Если в момент t коэффициент Q > K, то текущие активности продуктов больше равновесных, и значит они должны уменьшиться к тому моменту, когда установится равновесие, то есть в данный момент протекает обратная реакция; Если Q = K, то равновесное состояние достигнуто и скорости прямой и обратной реакций равны; Если Q < K, то v 1 > v − 1 {\displaystyle v_{1}>v_{-1}}
С использованием величины Q r {\displaystyle Q_{r}} записывается уравнение изотермы химической реакции
Δ G p , T = R T ln Q r − R T ln K e q = R T ln Q r K e q = ∑ ν i μ i {\displaystyle \Delta G_{p,T}=RT\ln Q_{r}-RT\ln K_{eq}=RT\ln {\frac {Q_{r}}{K_{eq}}}=\sum \nu _{i}\mu _{i}}Где ν {\displaystyle \nu } - стехиометрические коэффициенты (для продуктов - со знаком "+", для исходных веществ - со знаком "-"; так же, как и в выражениях для Q и K), а μ {\displaystyle \mu } - химические потенциалы а стандартная энергия Гиббса и стандартная константа суть
Δ G p , T o = − R T ln K e q o = ∑ ν i μ i o {\displaystyle \Delta G_{p,T}^{o}=-RT\ln K_{eq}^{o}=\sum \nu _{i}\mu _{i}^{o}}Где μ o {\displaystyle \mu ^{o}} - стандартные химические потенциалы
Уравнение изотермы показывает, как величина Q связана с изменением свободной энергии реакции:
При
Q
>
K
{\displaystyle Q>K}
для прямой реакции
Δ
G
>
0
{\displaystyle \Delta G>0}
, то есть
∑
ν
j
μ
j
{\displaystyle \sum \nu _{j}\mu _{j}}
для продуктов прямой реакции больше, чем для исходных веществ - это означает, что прямая реакция запрещена (значит, не запрещена обратная);
при
Q
=
K
{\displaystyle Q=K}
для прямой реакции
Δ
G
=
0
{\displaystyle \Delta G=0}
, то есть реакция достигла равновесного состояния;
при
Q
<
K
{\displaystyle Q
Величина по определению имеет смысл только для состояния равновесия, то есть для состояния с v 1 v − 1 = 1 {\displaystyle {\frac {v_{1}}{v_{-1}}}=1} и Δ G r = 0 {\displaystyle \Delta G_{r}=0} . Величина K e q {\displaystyle K_{eq}} ничего не говорит о скоростях реакций, но она описывает состав системы в состоянии равновесия.
Если K >> 1, то в системе преобладают продукты (прямой) реакции Если K << 1, то в системе преобладают исходные вещества (продукты обратной реакции)
Стандартные состояния
Стандартная энергия Гиббса реакции в газовой смеси - энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм). Стандартная энергия Гиббса реакции в растворе - энергия Гиббса при стандартном состоянии раствора, за которое принимают гипотетический раствор со свойствами предельно разбавленного раствора , но с концентрацией всех реагентов, равной единице. Для чистого вещества и жидкости стандартная энергия Гиббса совпадает с энергией Гиббса образования этих веществ. Величина стандартной энергии Гиббса реакции может быть использована для приближенной оценки термодинамической возможности протекания реакции в данном направлении, если начальные условия не сильно отличаются от стандартных. Кроме того, сравнивая величины стандартной энергии Гиббса нескольких реакций, можно выбрать наиболее предпочтительные, для которых имеет наибольшую по модулю отрицательную величину.
Кинетическое описание
Для обратимой химической реакции константа равновесия K eq может быть выражена через константы скорости прямых и обратных реакций. Рассмотрим элементарную обратимую химическую реакцию первого порядка
A ⇄ B {\displaystyle \mathrm {A} \rightleftarrows \mathrm {B} }По определению, равновесие задаётся условием v 1 = v − 1 {\displaystyle v_{1}=v_{-1}} , то есть равенством скоростей прямой и обратной реакций.
В соответствии с законом действующих масс v = k ∏ a j n j {\displaystyle v=k{\prod }{a_{j}}^{n_{j}}}
Где k - константа скорости соответствующей реакции, а a j n j {\displaystyle {a_{j}}^{n_{j}}} - равновесные активности реагентов этой реакции, возведённые в степени, равные их стехиометрическим коэффициентам
можно записать условие равновесия в виде
1 = v 1 v − 1 = k 1 ∏ a A n A k − 1 ∏ a B n B {\displaystyle 1={\frac {v_{1}}{v_{-1}}}={\frac {k_{1}{\prod }{a_{A}}^{n_{A}}}{k_{-1}{\prod }{a_{B}}^{n_{B}}}}} 1 = k 1 k − 1 ⋅ ∏ a A n A ∏ a B n B = k 1 k − 1 ⋅ (K e q) − 1 {\displaystyle 1={\frac {k_{1}}{k_{-1}}}\cdot {\frac {\prod {a_{A}}^{n_{A}}}{\prod {a_{B}}^{n_{B}}}}={\frac {k_{1}}{k_{-1}}}\cdot \left(K_{eq}\right)^{-1}}(см. термодинамическое описание константы равновесия), что возможно только если
K e q = k 1 k − 1 {\displaystyle K_{eq}={\frac {k_{1}}{k_{-1}}}}Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики .
Множественные равновесия
В случае, когда в системе устанавливается сразу несколько равновесий (то есть одновременного или последовательного протекает нескольких процессов), каждый из них может быть охарактеризован своей константой равновесия, из которых можно выразить общую константу равновесия для всей совокупности процессов. Можно рассмотреть такую ситуацию на примере ступенчатой диссоциации двухосновной кислоты H 2 A. Водный раствор её будет содержать частицы (сольватированные) H + , H 2 A, HA - and A 2- . Процесс диссоциации протекает в две ступени:
H 2 A ⇌ H A − + H + : K 1 = [ H A − ] [ H + ] [ H 2 A ] {\displaystyle H_{2}A\rightleftharpoons HA^{-}+H^{+}:K_{1}={\frac {}{}}} H A − ⇌ A 2 − + H + : K 2 = [ A 2 − ] [ H + ] [ H A − ] {\displaystyle HA^{-}\rightleftharpoons A^{2-}+H^{+}:K_{2}={\frac {}{}}}K 1 и K 2 - константы первой и второй ступеней диссоциации соответственно. Из них можно выразить "полную" константу равновесия, для процесса полной диссоциации :
H 2 A ⇌ A 2 − + 2 H + : K 1 + 2 = [ A 2 − ] [ H + ] 2 [ H 2 A ] = K 1 K 2 {\displaystyle H_{2}A\rightleftharpoons A^{2-}+2H^{+}:K_{1+2}={\frac {^{2}}{}}=K_{1}K_{2}}Другой пример множественного равновесия - анализ системы осадок /растворимое комплексное соединение . Допустим, имеется равновесие
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons AgI(solid)+I^{-}(aq)}Реакцию можно представить в виде двух последовательных равновесий - равновесия разложения комплексного иона на составляющие его ионы, которое характеризуется "константой нестойкости" (величина, обратная "константе устойчивости" β):
A g I 2 − (a q) ⇌ A g + (a q) + 2 I − (a q) : K 1 = α A g + α I − 2 α A g I 2 − = β − 1 {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons Ag^{+}(aq)+2I^{-}(aq):K_{1}={\frac {\alpha _{Ag^{+}}\alpha _{I^{-}}^{2}}{\alpha _{AgI_{2}^{-}}}}=\beta ^{-1}}и равновесия перехода ионов из объёма растворителя в кристаллическую решётку
A g + (a q) + I − (a q) ⇌ A g I (s o l i d) : K 2 = α A g I α A g + α I − {\displaystyle Ag^{+}(aq)+I^{-}(aq)\rightleftharpoons AgI(solid):K_{2}={\frac {\alpha _{AgI}}{\alpha _{Ag^{+}}\alpha _{I^{-}}}}}с учётом того, что для твёрдых веществ активность принимается равной 1 , а в разбавленных растворах активности могут быть заменены на молярные концентрации, получаем
K 2 = α A g I α A g + α I − = 1 [ A g + ] [ I − ] = 1 K s p {\displaystyle K_{2}={\frac {\alpha _{AgI}}{\alpha _{Ag^{+}}\alpha _{I^{-}}}}={\frac {1}{}}={\frac {1}{K_{sp}}}}где K s p {\displaystyle K_{sp}} - произведение растворимости
Тогда суммарное равновесие будет описываться константой
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) : K = α A g I α I − α A g I 2 − = K 1 ⋅ K 2 = 1 β ⋅ K s p {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons AgI(solid)+I^{-}(aq):K={\frac {\alpha _{AgI}\alpha _{I^{-}}}{\alpha _{AgI_{2}^{-}}}}=K_{1}\cdot K_{2}={\frac {1}{\beta \cdot K_{sp}}}}И значение этой константы будет условием преобладания в равновесной смеси комплексного соединения или твёрдой соли: как и выше, если K << 1, то в равновесной смеси большая часть ионов связана в комплексное соединение, если K >> 1, то в равновесном состоянии в системе большая часть ионов связана в кристаллической фазе. реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если Δ H > 0 {\displaystyle \Delta H>0} (тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия d ln K p d T {\displaystyle {\frac {d\ln K_{p}}{dT}}} тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).
Методы расчета константы равновесия
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG 0 ), а затем использованию формулы:
Δ G 0 = − R T ln K 0 {\displaystyle \Delta G^{0}=-RT\ln K^{0}} , где R {\displaystyle R} - универсальная газовая постоянная .При этом следует помнить, что энергия Гиббса - функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG 0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG 0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Энтропийный метод расчёта ΔG реакции является одним из самых распространённых и удобных . Он основан на соотношении:
Δ G T = Δ H T − T Δ S T {\displaystyle \Delta G_{T}=\Delta H_{T}-T\Delta S_{T}}или, соответственно, для стандартного изменения энергии Гиббса:
Δ G T 0 = Δ H T 0 − T Δ S T 0 {\displaystyle \Delta G_{T}^{0}=\Delta H_{T}^{0}-T\Delta S_{T}^{0}}Здесь ΔH 0 при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны - см., например, уравнение Кирхгофа :
Δ H T 0 = Δ H 298 0 + ∫ 298 T Δ C p d T {\displaystyle \Delta H_{T}^{0}=\Delta H_{298}^{0}+\int _{298}^{T}\Delta C_{p}dT}Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
- По термическим данным - с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
Итак, если известны Δ H 298 0 {\displaystyle \Delta H_{298}^{0}} , Δ S 298 0 {\displaystyle \Delta S_{298}^{0}} и температурные зависимости теплоёмкости, Δ G T 0 {\displaystyle \Delta G_{T}^{0}} может быть рассчитано по формуле:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + ∫ 298 T Δ C p d T − T ∫ 298 T Δ C p d T T {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}+\int _{298}^{T}\Delta C_{p}dT-T\int _{298}^{T}\Delta C_{p}{\frac {dT}{T}}}Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + Δ C p 298 (T − 298) − T ln T 298 {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}+\Delta C_{p~298}(T-298)-T\ln {\frac {T}{298}}}И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}}Переход от Δ G T 0 {\displaystyle \Delta G_{T}^{0}} к константе равновесия осуществляется по приведённой выше формуле.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
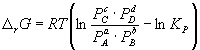 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
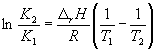 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X =  и K P = K X . P
–2
=
и K P = K X . P
–2
= 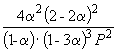 .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
