От чего зависит количество митохондрий. Митохондрии – строение и функции
Митохондрии (МТ) – одно из самых интересных мне направлений исследований. Объединение митохондрий с другой клеткой в ходе эндосимбиоза около 1,6 млрд лет назад стало основной всех многоклеточных эукариотов со сложной структурой. Предположительно митохондрии произошли от клеток, напоминающих α-протеобактерии.
Лучшее обзорное исследование последнего времени по митохондриях – работа Вернера Кулбрандта «Структура и функция митохондриальных белковых комплексов мембраны ». Если вы знаете английский язык и интересуетесь устройством этих органелл, то настоятельно рекомендую к прочтению. Эта статья так хороша, что может быть смело главой хорошего учебника по молекулярной биологии. Сначала я хотел перевести всю статью, но это бы заняло непростительно много времени и оторвало бы от других дел. Поэтому ограничусь тезисами и картинками. Периодически разбавляя все своими мыслями.
Митохондрия кодирует сама только 13 белков, не смотря на наличие отдельной от клетки ДНК (мтДНК) и всего «производственного» цикла по транскрипции белков. Изолированная митохондрия какое-то время может сохранять композицию и функционировать.
Рисунок 1. Компоненты мембраны митохондриона. Внешняя мембрана отделяет митохондрию от цитоплазмы. Она окружает внутреннюю мембрану, которая отделяет межмембранное пространство от богатого белками центрального матрикса. Внутреннюю мембрану разделяют на внутреннюю пограничную мембрану и кристы. Две эти части непрерывны в местах крепления крист (cristae junction ). Кристы простираются более или менее глубоко в матрикс и являются основным место митохондриального преобразования энергии. Небольшой протоновый градиент в межмембранном пространстве (pH 7,2-7,4) и матрикс (pH 7,9-8,0) приводят к образованию АТФ АТФ-синтазой в мембранах крист.
Внешняя мембрана пористая и позволяет веществам из цитоплазмы проходить через нее. Внутренняя мембрана плотная, для ее пересечения нужны транспортные белки [Гилберт Линг обоснованно не согласен], непрерывность барьера позволяет иметь внутренней мембране электрохимический потенциал в -180 mV. У матрикса довольно большой pH (7,9-8). Еще раз углублюсь в Линга. Щелочной (выше 7) pH способствует более развернутой конформации белков . Высокий pH нарушает водородные и солевые связи, делая поляризованные CO и NH доступными молекулам воды, там самым усиливая дипольный момент всей внутриклеточной воды и связывая ее. В этом ключе наличие мембраны нужно не для «удержания» протоплазмы внутри клетки (это делают сами белки при высоком pH), а для наличия потенциала.
мтДНК находится в нуклеотидах, которых примерно 1000 на клетку. Белковая плотность матрикса довольна высокая (до 500 мг/мл), что близко к кристаллизованным белкам.
Внутренняя мембрана образует инвагинации, называемые кристами, которые глубоко проникают в матрикс. Кристы определяют третий «отсек» митохондрий – просвет крист (cristae lumen). Мембраны кристы содержат большинство, если не все, полностью «собранные» комплексы цепи переноса электронов и АТФ-синтазы. Просвет кристы содержит большое количество маленького растворимого белкового переносчика электронов (цитохром с). Митохондриальные кристы, таким образом, основное место биологической конверсии энергии во всех не фотосинтетических эукариотах.
С кристами тоже много всего интересного. Оптические свойства кристы влияют на распространение и генерацию света в тканях. Я даже встречал идеи о том, что поверхность крист подобна (предположение) поверхностям топологических изоляторов (подразумевалась суперпроводимость без диссипации заряда).
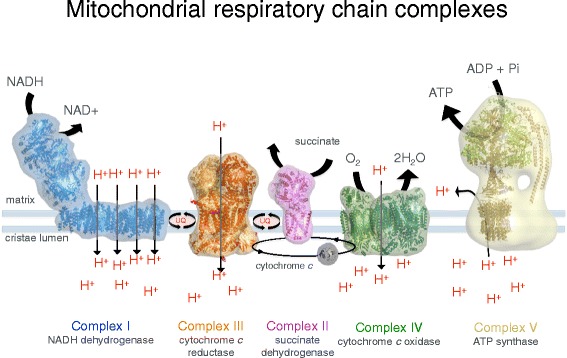
Рисунок 2. Мембранные белковые комплексы дыхательной цепи. Комплекс I (NADH / убихинон оксидоредуктаза, синий), Комплекс II (сукцинат дегидрогеназа, розовы), Комплекс III (цитохром С редуктаза, оранжевый), Комплекс IV (цитохром С оксидаза, зеленый) и митохондриальная АТФ синтаза (известная как комплекс V , бежевая) работают вместе во время окислительного фосфорилирования, чтобы клетки могли использовать энергию. Комплексы I , III , IV выкачивают протоны вдоль мембраны кристы, создавая протоновый градиент, стимулирующий синтез АТФ.
Теперь немного внимания на комплекс II. Вы помните, что жир (кето) делает упор в метаболизме на FADH2 и комплекс II. Они восстанавливают пару CoQ, в какой-то момент окисленного CoQ не хватает для транспортировки электронов на комплекс III и образует обратный поток электронов на комплекс I с образованием супероксида. При долгом HFLC-питании комплекс I будет обратимо разрушен, при этом это нормальная физиологическая оптимизация.
Еще прошу вас заметить, что комплекс II не выкачивает протоны. Что у нас рассеивает протоновый градиент, нарушает фосфорилирование и стимулирует сжигание жиров на тепло? Правильно, стресс холода. Термогенез связан с метаболизмом через комплекс, который не выкачивает протоны, тем самым не давая дополнительных протонов для АТФ-синтазы. Можно только удивляться как замечательно у нас продуман организм.
Крепления крист и MICOS
Места крепления крист (cristae junctions) – маленькие круглы отверстия примерно 25 нм диаметром. В митохондриях всех организмов есть система MICOS (mitochondria contact site and cristae to outer membrane), сборка из пяти мембранных и одного растворимого белков, прикрепляющих кристы к наружной мембране.
В клетках с повышенной потребностью в энергии, такие как скелетные и сердечные мышцы, кристы плотно заполняют большую часть объема митохондрии. В тканях с меньшими потребностями в энергии, таких как печень и почки, кристы находятся не так плотно по отношению друг к другу. Остается больше места в матрице для биосинтетических ферментов.

Рисунок 3. Томографический объем митохондрии сердца мыши. А) Трехмерный объем митохондрии сердца мыши, снятый cryo-ET. Наружная мембрана (серая) окутывает внутреннюю мембрану (светло-синяя). Внутренняя мембрана плотно наполнена кристами б) Томографический срез объема. Плотно заполненный матрикс, содержащий большую часть митохондриальных белков, выглядит темным на электронном микроскопе. В то время как межмембранное пространство и просветы крист выглядят светлыми из-за низкой концентрации белков.
Димеры АТФ синтазы
Митохондриальная F1-F0 АТФ синтаза является самым заметным белковым комплексом кристы. АТФ синтаза – это древняя наномашина, которая использует электрохимический протновых градиент вокруг внутренней мембраны для создания АФТ посредством вращательного катализа . Протоны, двигающиеся через F0 комплекс мембраны, вращают ротор из 8 (у млекопитающих) или 10 (у дрожжей) с-узлов. Центральный стебель передает крутящий момент c-ротора каталитической головке F1, где АТФ образуется из АДФ и фосфата через последовательность конформационных изменения. Периферийный стебель предотвращает непродуктивное вращение Головы F1 против комплекса F0.
Многие годы считалось, что АТФ синтаза случайным образом располагается на внутренней мембране. Но оказалось, что АТФ синтаза располагается двойными рядами . Причем линейные ряды АТФ синтазы – фундаментальный атрибут всех живых митохондрий.

Рисунок 4. Двойные ряды АТФ синтазы у семи разных видов.
Ряды АТФ синтазы располагаются в основном вдоль хребтов крист. Димеры изгибают липидный бислой и как следствие само-организуются в ряды. Когда у митохондрий дрожжей выбивали узлы e и g АФТ синтазы, то штамм рос на 60% медленней диких собратьев, и потенциал мембран их митохондрий был снижен вдвое. У АФТ синтазы прокариотов недостает нескольких узлов, связанных с димерами, ряды димеров не были найдены у бактерий и архей. Кристы и ряды димеров АФТ синтазы, таким образом, являются адаптацией к большим энергетическим потребностям организма.

Рисунок 5. Структура димера АТФ синтазы митохондрии polymella sp. Вид сбоку на V-образный димер АТФ синтазы.
Комплексы и суперкомплексы дыхательной цепи
Протоновый градиент вокруг внутренней мембраны создается тремя крупными мембранными комплексами, известными как комплекс I, комплекс III и комплекс IV (см. рисунок 2). Комплекс I кормится электронами из NADH, высвобождаемая при передаче электрона энергия выкачивает четыре протона. Комплекс III получает электрон от восстановленного хинола и передает его носителю электронов (цитохрому с), выкачивая в процессе один протон. Комплекс IV получает электрон из цитохрома с и передает его молекулярному кислороду, выкачивая 4 протона за каждую молекулу кислорода, превращенную в воду. Комплекс II не выкачивает протоны, напрямую передавая электроны хинолу. Как перенос электронов из NADH в хинол связан с транслокацией протонов пока не ясно. Комплекс I – крупнее III и IV вместе взятых.

Рисунок 6. Комплекс I митохондрии коровьего сердца. Матриксная часть содержит ряд из восьми железно-серных (Fe-S) кластеров, которые направляют электроны из NADH в хинол на пересечении матрикса и мембраны. Мембранная часть состоит из 78 лопастей, включая выкачивающие протоны молекулы.
Комплексы I, III и IV соединяются в суперкомплексы или респирасомы. У пекарских дрожжей (saccharomyces cerevisiae ) нет комплекса I, их суперкомплексы состоят из III и IV. Роль суперкомплексов пока еще не ясна. Предполагают, что это делает транспорт электронов более эффективным, но прямых доказательств этому пока нет.

Рисунок 7. Суперкомплекс митохондрии коровьего сердца. Обратите внимание на дистанцию между комплексами I и III, который надо проделать хинолу. Стрелки – движения электрона в суперкомплексе.
Основным белком просвета кристы является цитохром с, который переносит электрон из комплекса III в комплекс IV. Если цитохром с высвобождается в цитоплазму клетки, то вызывает апоптоз .

Рисунок 8. Ряды димеров АТФ синтазы задают форму кристам. У хребта кристы АФТ синтаза (желтый) образует слив для протонов (красный), протоновые насосы электронной цепи (зеленый) находятся по обоим сторона рядов димеров. Направляя протоны от источника к АТФ синтазе, кристы работают как протоновые направляющие, позволяющие эффективное производство АТФ. Красные стрелки показывают направление потока протонов.
Реорганизация мембраны во время старения
Старение – фундаментальный и плохо понимаемый процесс всех эукариотов. Исследовали старение митохондрий на грибах Podospora anserina , которые живут всего 18 дней. В нормальной митохондрии кристы проникают глубоко в матрикс. Для этого нужны ряды димеров АТФ синтазы и MICOS комплекс у мест крепления крист. С возрастом кристы начинают все ближе подходить к поверхности мембраны, димеры АФТ синтазы превщаются в мономеры, и все заканчивается высвобождением цитохрома с и клеточной смертью.
Транспорт электронов создает супероксид в комплексах I и III. Это побочный продукт метаболизма. Одновременно необходимый и смертельно опасный. Во время старения деление (fission) начинает превалировать над сращением (fussion). Это не дает поврежденным митохондриям «спастись» путем сращения и ускоряет неизбежное.

Рисунок 9. Изменения морфологии внутренней мембраны и димеров АТФ синтазы во время старения митохондрии.
Как видите, полей для будущих исследований очень много. Я предполагаю стык физики и биологии, где физики будут пытаются объяснить почему такая структура более энергетически эффективна. Тем более публикации по квантовой биологии
II. Митохондрии (строение и функции)
Полисомы. Синтез цитоплазматических белков
Рибосомы представляют собой мельчайшие органеллы, присутствующие в цитоплазме клетки. Несмотря на свои размеры, они являются сложными молекулярными ансамблеями, состоящими из рибосомальной РНК (р-РНК) различной длины и рибосомальных белков . В цитоплазме рибосомы встречаются в виде 2-х форм:
1. В диссоциированном состоянии (две субъединицы: малая и большая), которое свидетельствует об их неактивном статусе;
2. В ассоциированном виде – это форма их активного статуса.
Большая субъединица образуется тремя молекулами РНК, имеет форму полушара с 3 выступами, взаимодействующие с «шипиками» малой субъединицы.
Малая субъединица содержит лишь одну молекулу РНК и выглядит в виде «шапочки» с шипиками, обращёнными в сторону большой субъединицы. Ассоциация субъединиц рибосомы – это взаимодействие рельефов их поверхностей.
Функции субъединиц:
1. Малая ответственна за связывание с матричной РНК;
2. Большая – за образование полипептидной цепи.
Полисомы – это группа рибосом (от 5 до 30) связанных нитью м-РНК с образованием функционального комплекса. На нём происходит синтез цитоплазматических белков, необходимых клетке для роста, развития органелл дифференцировки.
Этапы синтеза цитоплазматических белков:
1. Выход из ядра м-РНК;
2. Сборка рибосом;
3. Образование функциональной полисомы;
4. Синтез сигнального пептида;
5. Считывание последовательности аминокислот в составе пептида сигнал-распознающей частицы (СРЧ);
6. Завершение синтеза цитоплазматического белка на полисоме. См рис. 1
Рис. 1: Схема синтеза цитоплазматических белков
II. Митохондрии (строение и функции)
Митохондрии – это система энергообеспечения клетки. На светооптическом уровне их выявляют при окраске по Альтману, они выглядят в виде зёрнышек и нитей. В цитоплазме они распределены диффузно, а в специализированных клетках сосредоточенны в участках, где имеется наибольшая потребность в энергии.
 Электронномикроскопический уровень организации митохондрии
: в ней выделяют две мембраны: наружную и внутреннюю. См. рис. 2
Электронномикроскопический уровень организации митохондрии
: в ней выделяют две мембраны: наружную и внутреннюю. См. рис. 2
Рис. 2: Схема строения митохондрии
Наружная мембрана – это мешок с относительно ровной поверхностью, она по химическому составу и свойствам близка к плазмолемме, отличается она более высокой проницаемостью и содержит ферменты метаболизма жирных кислот, фосфолипидов и липидов.
Функция:
1. Отграничение митохондрии в гиалоплазме;
2. Транспорт в митохондрию субстратов для клеточного дыхания.
Внутренняя мембрана – неровная, она формирует кристы в виде пластин (ламеллярные кристы) с увеличением площади её поверхности. Главным компонентом этой мембраны являются молекулы белков, относящиеся к ферментам дыхательной цепи, цитохромы.
На поверхности крист в некоторых клетках описывают грибовидные частицы (F 1 -частицы), в которых различают головку (9 нм) и ножку (3 нм). Считают, что именно здесь происходит синтез АТФ и АДФ.
Между наружной и внутренней мембранами образуется небольшое (около 15 – 20 нм) пространство, которое называют наружной камерой митохондрий. Внутренняя камера ограничена соответственно внутренней митохондриальной мембраной и содержит матрикс.
Матрикс митохондрий имеет гелеобразную фазу и отличается высоким содержанием белка. В нём встречаются митохондриальные гранулы – частицы диаметром 20 – 50 нм высокой электронной плотности, они содержат ионы Са 2+ и Mg 2+ . Матрикс митохондрий содержит также митохондриальные ДНК и рибосомы. На первых происходит синтез транспортных белков митохондриальных мембран и некоторых белков, участвующих в фосфолировании АДФ. ДНК здесь состоит из 37 генов и не содержит некодирующие последовательность нуклеотидов.
Функции митохондрий:
1. Обеспечение клетки энергией в виде АТФ;
2. Участие в синтезе стероидных гормонов;
3. Участие в синтезе нуклеиновых кислот;
4. Депонирование кальция.
Митохондрии – строение и функции
| Наименование параметра | Значение |
| Тема статьи: | Митохондрии – строение и функции |
| Рубрика (тематическая категория) | Экология |
Общая морфология. Митохондрии или хондриосомы (от греч. mitos– нить, chondrion- зернышко, soma- тельце) представляют из себягранулярные или нитевидные органеллы, присутствующие в цитоплазме простейших, растений и животных (рис. 198). Митохондрии можно наблюдать в живых клетках, так как они обладают достаточно высокой плотностью. В живых клетках митохондрии могут двигаться, перемещаться, сливаться друг с другом.
У разных видов размеры митохондрий очень непостоянны, так же как изменчива их форма (рис. 199). Все же у большинства клеток толщина этих структур относительно постоянна (около 0,5 мкм), а длина колеблется, достигая у нитчатых форм до 7-60 мкм.
Изучение величины и числа митохондрий не такое простое дело. Это связано с тем, что размеры и число митохондрий, которые видны на ультратонких срезах, не соответствуют реальности.
Обычные же подсчеты показывают, что на печеночную клетку приходится около 200 митохондрий. Это составляет более 20% от общего объёма цитоплазмы и около 30-35% от общего количества белка в клетке. Площадь поверхности всех митохондрий печеночной клетки в 4-5 раз больше поверхности ее плазматической мембраны. Больше всего митохондрий в ооцитах (около 300000) и у гигантской амебы Chaos chaos (до 500000).
В клетках зеленых растений число митохондрий меньше, чем в клетках животных, так как часть их функций могут выполнять хлоропласты.
Локализация митохондрии в клетках различна. Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТФ, образующейся в митохондриях. Так, в скелетных мышцах митохондрии находятся вблизи миофибрилл. В сперматозоидах митохондрии образуют спиральный футляр вокруг оси жгутика; вероятно, это связано с крайне важно стью использования АТФ для движения хвоста сперматозоида. Аналогичным образом у простейших и в других клетках, снабженных ресничками, митохондрии локализуются непосредственно под клеточной мембраной у основания ресничек, для работы которых необходим АТФ. В аксонах нервных клеток митохондрии располагаются около синапсов, где происходит процесс передачи нервного импульса. В секреторных клетках, которые синтезируют большие количества белков, митохондрии тесно связаны с зонами эргастоплазмы; вероятно, они поставляют АТФ для активации аминокислот и синтеза белка на рибосомах.
Ультраструктура митохондрий. Митохондрии независимо от их величины или формы имеют универсальное строение, их ультраструктура однообразна. Митохондрии ограничены двумя мембранами (рис. 205). Наружняя митохондриальная мембрана отделяет ее от гиалоплазмы, она имеет ровные контуры, не образует впячиваний или складок, толщина составляет около 7 нм. На нее приходится около 7% от площади всех клеточных мембран. Мембрана не связана ни с какими другими мембранами цитоплазмы, замкнута сама на себя и представляет собой мембранный мешок. Наружнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии, ее матрикс или митоплазму. Внутренняя мембрана митохондрий образовывает многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист (рис. 206, 207а).
Общая поверхность внутренней мембраны митохондрии в печеночной клетке составляет примерно треть поверхности всех клеточных мембран. Митохондрии клеток сердечной мышцы содержат втрое больше крист, чем печеночные митохондрии что отражает различия в функциональных нагрузках митохондрий разных клеток. Расстояние между мембранами в кристе составляет около 10-20 нм.
Митохондриальные кристы, отходящие от внутренней мембраны и простирающиеся в сторону матрикса, не перегораживают полностью полость митохондрии и не нарушают непрерывности заполняющего ее матрикса.
Ориентация крист по отношению к длинной оси митохондрии различна для разных клеток. Ориентация должна быть перпендикулярная (клетки печени, почек) крист; в сердечной мышце наблюдается продольное расположение крист. Кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации (рис. 208). У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
Матрикс митохондрий имеет тонкозернистое гомогенное строение, в котором выявляются молекулы ДНК в виде тонких собранных в клубок нитей (около 2-3 нм) и митохондриальные рибосомы имеющие форму гранул размером около 15-20нм. Места отложения солей магния и кальция в матриксе образуют крупные (20-40 нм) плотные гранулы.
Функции митохондрий. Митохондрии осуществляют синтез АТФ, происходящий в результате процессов окисления органических субстратов и фосфорилирования АДФ.
Начальные этапы окисления углеводов называются анаэробным окислением, или гликолизом и происходят в гиалоплазме и не требуют участия кислорода. Субстратом окисления при анаэробном получении энергии служат гексозы и в первую очередь глюкоза; некоторые бактерии обладают свойством извлекать энергию, окисляяя пентозы, жирные кислоты или аминокислоты.
В глюкозе количество потенциальной энергии, заключенной в связях между атомами С, Н и О, составляет около 680 ккал на 1 моль (ᴛ.ᴇ. на 180 г глюкозы).
В живой клетке это огромное количество энергии освобождается в виде ступенчатого процесса, управляемого целым рядом окислительных ферментов, и не связано с переходом энергии химической связи в тепло, как при горении, а переходит в макроэнергетическую связь в молекулах АТФ, которые синтезируются при использовании освобождающейся энергии из АДФ и фосфата.
Образовавшиеся в результате гликолиза триозы, и в первую очередь пировиноградная кислота͵ в митохондриях вовлекаются в дальнейшее окисление. При этом происходит использование энергии расщепления всех химических связей, что приводит к выделению СО 2, к потреблению кислорода и синтезу большого количества АТФ. Эти процессы связаны с окислительным циклом трикарбоновых кислот и с дыхательной цепью переноса электронов, где происходит фосфорилирование АДФ и синтез клеточного “топлива”, молекул АТФ (рис. 209).
В цикле трикарбоновых кислот (цикл Кребса, или цикл лимонной кислоты) образовавшийся в результате гликолиза пируват сначала теряет молекулу СО 2 и, окисляясь до ацетата (двууглеродное соединение), соединяется с коферментом А. Далее ацетилкоэнзим А, соединяясь с оксалацетатом (четырехуглеродное соединение), образует шестиуглеродный цитрат (лимоную кислоту). Далее происходит цикл окисления этого шестиуглеродного соединения до четырехуглеродного оксалацетата͵ снова связывание с ацетилкоэнзимом А, и затем цикл повторяется. При этом окислении выделяются две молекулы СО 2, а электроны, освободившиеся при окислении, переносятся на акцепторные молекулы коферментов (NAD-никотинамидадениндинуклеотид), которые вовлекают их далее в цепь переноса электронов. Следовательно, в цикле трикарбоновых кислот нет самого синтеза АТФ, а идет окисление молекул, перенос электронов на акцепторы и выделение СО 2 . Все описанные выше события внутри митохондрий происходят в их матриксе.
Окисление исходного субстрата приводит к выделению СО 2 и воды, но при этом не выделяется тепловая энергия, как при горении, а образовываются молекулы АТФ. Οʜᴎ синтезируются другой группой белков, не связанных прямо с окислением. Во внутренних митохондриальных мембранах на поверхности мембран, смотрящих в матрикс, располагаются крупные белковые комплексы, ферменты, АТФ-синтетазы. В электронном микроскопе они видны в виде так называемых “грибовидных” телец сплошь выстилающие поверхность мембран, смотрящую в матрикс. Тельца имеют как бы ножку и головку, диаметром 8-9 нм. Следовательно, во внутренних мембранах митохондрий локализованы ферменты как окислительной цепи, так и ферменты синтеза АТФ (рис. 201б).
Дыхательная цепь - ϶ᴛᴏ главная система превращения энергии в митохондриях. Здесь происходит последовательное окисление и восстановление элементов дыхательной цепи, благодаря чему высвобождается небольшими порциями энергия. За счёт этой энергии в трех точках цепи из АДФ и фосфата образуется АТФ. По этой причине говорят, что окисление (перенос электронов) сопряжено с фосфорилированием (АДФ + Фн →АТФ, ᴛ.ᴇ. происходит процесс окислительного фосфорилирования.
Выделяющаяся при транспорте электронов энергия запасается в виде градиента протонов на мембране. Оказалось, что при переносе электронов в митохондриальной мембране каждый комплекс дыхательной цепи направляет свободную энергию окисление на перемещение протонов (положительных зарядов) через мембрану, из матрикса в межмембранное пространство, что приводит к образованию разности потенциалов на мембране: положительные заряды преобладают в межмембранном пространстве, а отрицательные – со стороны матрикса митохондрий. При достижении разности потенциалов (220 мВ) белковый комплекс АТФ-синтетазы начинает транспортировать протоны обратно в матрикс, при этом превращает одну форму энергии в другую: образует АТФ из АДФ и неорганического фосфата. Так происходит сопряжение окислительных процессов с синтетическим, с фосфорилированием АДФ. Пока происходит окисление субстратов, пока происходит перекачка протонов через внутреннюю митохондриальную мембрану – идет сопряженный с этим синтез АТФ, ᴛ.ᴇ. происходит окислительное фосфорилирование.
Эти два процесса можно разобщить. При этом продолжается перенос электронов, как и окисление субстрата͵ но синтеза АТФ не происходит. В этом случае энергия, освобождающаяся при окислении переходит в тепловую энергию.
Окислительное фосфорилирование у бактерий . У прокариотических клеток, способных к окислительному фосфорилированию, элементы цикла трикарбоновых кислот локализованы прямо в цитоплазме, а ферменты дыхательной цепи и фосфорилирования связаны с клеточной мембраной, с ее выпячиваниями, выступающими внутрь цитоплазмы, с так называемыми мезосомами (рис. 212). Надо отметить, что такие бактериальные мезосомы бывают связаны не только с процессами аэробного дыхания, но и у некоторых видов участвовать в делении клеток, в процессе распределения ДНК по новым клеткам, в образовании клеточной стенки и т.д. На плазматической мембране в мезосомах некоторых бактерий реализуются сопряженные процессы как окисления так и синтеза АТФ. В электронном микроскопе во фракциях плазматических мембран бактерий обнаружены сферические частицы, аналогичные тем, которые были найдены в митохондриях эукариотических клеток. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, у бактериальных клеток, способных к окислительному фосфорилированию, плазматическая мембрана выполняет роль, аналогичную внутренней мембране митохондрий эукариотических клеток.
Увеличение числа митохондрий. Митохондрии могут увеличивать свою численность особенно при делении клеток или при увеличении функциональной нагрузки клетки. Происходит постоянное обновление митохондрий. К примеру, в печени средняя продолжительность жизни митохондрий составляет около 10 дней.
Увеличение числа митохондрий происходит путем роста и деления предшествующих митохондрий. Это предположение было впервые высказано Альтманом (1893), описавшим митохондрии под термином “биобласты”. Удается наблюдать прижизненно деление, фрагментацию длинных митохондрий на более короткие путем перетяжки, что напоминает бинарный способ деления бактерий.
Реальное увеличение числа митохондрий путем деления установлено при изучении поведения митохондрий в живых клетках культуры ткани. В течение клеточного цикла митохондрии вырастают до нескольких мкм, а затем фрагментируются, делятся на более мелкие тельца.
Митохондрии могут сливаться друг с другом и размножаться по принципу: митохондрия от митохондрии.
Авторепродукция митохондрий. Двумембранные органеллы обладают полной системой авторепродукции. В митохондриях и пластидах существует ДНК, на которой синтезируются информационные, трансферные и рибосомные РНК и рибосомы, осуществляющие синтез митохондриальных и пластидных белков. При этом, эти системы, хотя и автономны, но ограничены по своим возможностям.
ДНК в митохондриях представляет собой циклические молекулы без гистонов и тем самым напоминают бактериальные хромосомы. Размер их составляет около 7 мкм, в одну циклическую молекулу митохондрий животных входит 16-19 тыс. нуклеотидных пар ДНК. У человека митохондриальная ДНК содержит 16,5 тыс. н.п., она полностью расшифрована. Найдено, что митохондральная ДНК различных объектов очень однородна, отличие их заключается лишь в величине интронов и нетранскрибируемых участков. Все митохондриальные ДНК представляют множественные копии, собранными в группы, кластеры. Так в одной митохондрии печени крысы может содержаться от 1 до 50 циклических молекул ДНК. Общее же количество митохондриальной ДНК на клетку составляет около одного процента. Синтез митохондриальных ДНК не связан с синтезом ДНК в ядре.
Так же как и у бактерий митохондральная ДНК собрана в отдельную зону – нуклеоид, его размер составляет около 0, 4 мкм в диаметре. В длинных митохондриях должна быть от 1 до 10 нуклеоидов. При делении длинной митохондрии от нее отделяется участок, содержащий нуклеоид (сходство с бинарным делением бактерий). Количество ДНК в отдельных нуклеоидах митохондрий может колебаться в 10 раз исходя из типа клеток.
В некоторых культурах в клетках от 6 до 60% митохондрий не имеют нуклеоида, что может объясняться тем, что деление этих органелл скорее связано с фрагментацией, а не с распределением нуклеоидов.
Как уже говорилось, митохондрии могут как делиться, так и сливаться друг с другом. При слиянии митохондрий друг с другом может происходить обмен их внутренними компонентами.
Важно подчеркнуть, что рРНК и рибосомы митохондрий и цитоплазмы резко отличны. В случае если в цитоплазме обнаруживаются 80s рибосомы, то рибосомы митохондрий растительных клеток принадлежат к 70s рибосомам (состоят из 30s и 50s субъединиц, содержат 16s и 23s РНК, характерные для прокариотических клеток), а в митохондриях клеток животных обнаружены более мелкие рибосомы (около 50s).
Рибосомные РНК митохондрий синтезируются на митохондриальных ДНК. В митоплазме на рибосомах идет синтез белков. Он прекращается, в отличие от синтеза на цитоплазматических рибосомах, при действии антибиотика хлорамфеникола, подавляющего синтез белка у бактерий.
На митохондриальном геноме синтезируются 22 транспортные РНК. Триплетный код митохондриальной синтетической системы отличен от такового, используемого в гиалоплазме. Несмотря на наличие казалось бы всех компонентов, необходимых для синтеза белков, небольшие молекулы митохондриальной ДНК не могут кодировать все митохондриальные белки, только лишь их небольшую часть. Так ДНК размером 15 тыс.н.п. может кодировать белки с суммарным молекулярным весом около 6х10 5 . В это же время суммарный молекулярный вес белков частицы полного дыхательного ансамбля митохондрии достигает величины около 2х10 6 . В случае если учесть, что кроме белков окислительного фосфорилирования в митохондрии входят ферменты цикла трикарбоновых кислот, ферменты синтеза ДНК и РНК, ферменты активации аминокислот и другие белки, то видно, что, для того чтобы кодировать эти многочисленные белки и рРНК и тРНК, количества генетической информации в короткой молекуле митохондриальной ДНК явно не хватает. Расшифровка нуклеотидной последовательности митохондриальной ДНК человека показала, что она кодирует всего лишь 2 рибосомные РНК, 22 трансферных РНК и всего 13 различных полипептидных цепей.
Сегодня доказано, что большая часть белков митохондрий находится под генетическим контролем со стороны клеточного ядра и синтезируется вне митохондрий. Большинство митохондриальных белков синтезируется на рибосомах в цитозоле. Эти белки имеют специальные сигнальные последовательности, которые узнаются рецепторами на внешней мембране митохондрий. Эти белки могут встраиваться в них (см. аналогию с мембраной пероксисом), а затем перемещаться на внутреннюю мембрану. Этот перенос происходит в точках контакта наружной и внутренней мембран, где такой транспорт отмечен (рис. 214). Большинство липидов митохондрий так же синтезируются в цитоплазме.
Все это говорит о эндосимбиотическом происхождении митохондрий, о том, что митохондрии представляют из себяорганизмы типа бактерий, находящиеся в симбиозе с эукариотический клеткой.
Хондриом. Совокупность всех митохондрий в одной клетке принято называть хондриомом. Она должна быть различной исходя из типа клеток. Во многих клетках хондриом состоит из разрозненных многочисленных митохондрий, равномерно расположенных по всей цитоплазме или локализуются группами в местах интенсивной траты АТФ. В обоих этих случаях митохондрии функционируют поодиночке, их кооперативная работа͵ возможно, координируется какими-то сигналами из цитоплазмы. Существует и совершенно иной тип хондриома, когда вместо мелких одиночных разрозненных митохондрий в клетке располагается одна гигантская разветвленная митохондрия (рис. 215в). Такие митохондрии встречаются у одноклеточных зеленых водорослей (к примеру у Chlorella). Οʜᴎ образуют сложную митохондриальную сеть или митохондриальный ретикулум (Reticulum miyochondriale). Согласно хемоосмотической теории биологический смысл появления такой гигантской разветвленной митохондриальной структуры, объединенной в одно целое своими внешними и внутренними мембранами состоит по сути в том, что в любой точке поверхности внутренней мембраны такой разветвленной митохондрии может идти синтез АТФ, который будет поступать в любую точку цитоплазмы, где в данном есть крайне важно сть.
В случае гигантских разветвленных митохондрий в любой ее точке может на внутренней мембране накопиться потенциал, достаточный для того, чтобы начался синтез АТФ. С этих позиций митохондриальный ретикулум представляет собой как бы электрический проводник, кабель, соединяющий отдаленные точки такой системы. Митохондриальный ретикулум оказался очень полезным не только для мелких подвижных клеток, таких как хлорелла, но и для более крупных структурных единиц таких как, к примеру, миофибриллы в скелетных мышцах.
Известно, что скелетные мышцы состоят из массы мышечных волокон, симпластов, содержащих множество ядер.
Размещено на реф.рф
Длина таких мышечных волокон достигает 40 мкм, при толщине 0,1 мкм - ϶ᴛᴏ гигантская структура, содержащая великое множество миофибрилл, все из которых сокращаются одновременно, синхронно. Важно заметить, что для сокращения к каждой единице сокращения, к миофибрилле, доставляется большое количество АТФ, которых обеспечивают митохондрии на уровне z-дисков. На продольных ультратонких срезах скелетных мышц в электронном микроскопе видны многочисленные округлые мелкие сечения митохондрий, располагающихся в соседстве с саркомерами (рис. 217). Мышечные митохондрии представляют из себяне мелкие шарики или палочки, а как бы паукообразные структуры, отростки которых ветвятся и простираются на большие расстояния, иногда через весь поперечник мышечного волокна. При этом разветвления митохондрий окружают каждую миофибриллу в мышечном волокне, снабжая их АТФ, крайне важно го для мышечного сокращения. Следовательно, в плоскости z-диска митохондрии представляют типичный митохондриальный ретикулум. Такой пласт или этаж митохондриального ретикулума повторяется дважды на каждый саркомер, а все мышечное волокно имеет тысячи поперечно расположенных “поэтажных” пластов митохондриального ретикулума. Между “этажами” вдоль миофибрилл располагаются нитчатые митохондрии, соединяющие эти митохондриальные пласты. Таким образом создана трехмерная картина митохондриального ретикулума, проходящего через весь объём мышечного волокна (рис. 218).
Далее было установлено, что между ответвлениями митохондриального ретикулума и нитевидными продольными митохондриями существуют специальные межмитохондриальные соединения или контакты (ММК). Οʜᴎ образованы плотно прилегающими наружными митохондриальными мембранами контактирующих митохондрий, межмембранное пространство и мембраны в этой зоне имеют повышенную электронную плотность (рис. 219). Через эти специальные образования происходит функциональное объединение соседних митохондрий и митохондриальных ретикулумов в единую, кооперативную энергетическую систему. Все миофибриллы в мышечном волокне сокращаются синхронно по всей их длине, следовательно, и поступление АТФ на любом участке этой сложной машины тоже должно происходить синхронно, а это может происходить лишь в том случае, в случае если огромное количество разветвленных митохондрий-проводников будет связано друг с другом с помощью контактов.
О том, что межмитоходриальные контакты (ММК) участвуют в энергетическом объединении митохондрий друг с другом удалось на кардиомиоцитах, клетках сердечных мышц.
Хондриом клеток сердечной мышцы не образует ветвящихся структур, а представлен множеством небольших вытянутых митохондрий, располагающихся без особого порядка между миофибриллами. При этом, все соседние митохондрии стыкуются друг с другом с помощью митохондриальных контактов такого же типа, как в скелетной мышце, только их число очень велико: в среднем на одну митохондрию приходится 2-3 ММК, которые связывают митохондрии в единую цепь, где каждым звеном такой цепи (Streptio mitochondriale) является отдельная митохондрия (рис. 220).
Оказалось, что межмитохондриальные контакты (ММК), как обязательная структура сердечных клеток обнаружены в кардиомиоцитах как желудочков, так и предсердий всех позвоночных животных: млекопитающих, птиц, пресмыкающихся, амфибий и костистых рыб. Более того ММК были обнаружены (но в меньшем числе) в клетках сердца некоторых насекомых и моллюсков.
Количество ММК в кардиомиоцитах изменяется исходя из функциональной нагрузки на сердце. Число ММК увеличивается при повышении физических нагрузок животных и, напротив - при падении нагрузки на сердечную мышцу происходит резкое сокращение числа ММК.
Митохондрии – строение и функции - понятие и виды. Классификация и особенности категории "Митохондрии – строение и функции" 2017, 2018.
О СЛОЖНОМ ПРОСТЫМ ЯЗЫКОМ.
Тема эта сложная и комплексная, затрагивающая сразу же огромное количество биохимических процессов происходящих в нашем организме. Но давайте все таки попробуем разобраться, что же такое митохондрии и как они работают.
И так, митохондрии это одна из самых важных составляющих живой клетки. Если говорить простым языком то можно сказать, что это энергетическая станция клетки. Их деятельность основана на окисление органических соединений и генерации электрического потенциала (энергии освободившейся при распаде молекулы АТФ) для осуществления мышечного сокращения.
Все мы знаем, что работа нашего организма происходит в строгом соответствии с первым законом термодинамики. Энергия не создается в нашем организме, а лишь превращается. Организм только выбирает форму трансформации энергии, не производя ее, от химической к механической и тепловой. Основным источником всей энергии на планете Земля является Солнце. Приходя к нам в форме света, энергия поглощается хлорофиллом растений, там она возбуждает электрон атома водорода и таким образом дает энергию живой материи.
Своей жизнью мы обязаны энергии маленького электрона.
Работа митохондрии заключается в ступенчатом переносе энергии электрона водорода между атомами металлов, присутствующих в группах белковых комплексов дыхательной цепи (электронно-транспортной цепи белков), где каждый последующий комплекс обладает более высоким сродством к электрону притягивая его, чем предыдущий, до тех пор, пока электрон не соединиться с молекулярным кислородом, обладающим наибольшим сродством к электрону.
Каждый раз при передачи электрона по цепи высвобождается энергия которая аккумулируется в виде электрохимического градиента и затем реализовывается в виде мышечного сокращения и выделения тепла.
Серия окислительных процессов в митохондрии позволяющая перенести энергетический потенциал электрона называется «внутриклеточным дыханием» или часто «дыхательной цепью», так как электрон по цепочки передается от атома к атому до тех пор пока не достигнет своей конечной цели атома кислорода.
Митохондриям нужен кислород для переноса энергии в процессе окисления.
Митохондрии потребляют до 80% кислорода который мы вдыхаем.
Митохондрия представляет из себя постоянную структуру клетки, расположенную в ее цитоплазме. Размер митохондрии обычно составляет от 0,5 до 1 мкм в диаметре. По форме она имеет зернистую структуру и может занимать до 20% объема клетки. Такая постоянная органическая структура клетки называется органелла. К органеллам относятся и миофибриллы – сократительные единицы мышечной клетки; и ядро клетки это тоже органелла. Вообще, любая постоянная структура клетки является органоидом-органеллой.
Открыл митохондрии и впервые описал немецкий анатом и гистолог Рихард Альтман в 1894 году, а название этой органелле дал другой немецкий гистолог К. Бенд в 1897 году. Но только в 1920 году, опять же немецкий биохимик Отто Вагбург, доказал, что с митохондриями связаны процессы клеточного дыхания.
Существует теория, согласно которой митохондрии появились в результате захвата примитивными клетками, клетками которые сами не могли использовать кислород для генерации энергии, бактерий протогенотов, которые могли это делать. Именно потому, что митохондрия ранее представляла из себя отдельный живой организм она и по сей день обладает собственным ДНК.
Митохондрии ранее представляли из себя самостоятельный живой организм.
В ходе эволюции прогеноты предали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру и перестали быть самостоятельными организмами. Митохондрии присутствуют во всех клетках. Даже в сперматозоиде есть митохондрии.
Именно благодаря им приводится в движение хвостик сперматозоида осуществляющий его движение. Но особенно много митахондрий в тех местах, где необходима энергия для любых жизненных процессов. И это конечно прежде всего мышечные клетки.
В мышечных клетках митохондрии могут объединяться в группы гигантских разветвленных митохондрий, связанных друг с другом с помощью межмитохондриальных контактов, в которых они создают согласованную работающую кооперативную систему. Пространство в такой зоне имеет повышенную электронную плотность. Новые митохондрии образуются путем простого деления предыдущих органелл. Наиболее «простой» и доступный всем клеткам механизм энергетического обеспечения чаще всего называют общим понятием гликолиз.
Это процесс последовательного разложения глюкозы до пировиноградной кислоты. Если этот процесс происходит без участия молекулярного кислорода или с недостаточным его присутствием, то он называется анаэробный гликолиз. При этом глюкоза расщепляется не до конечных продуктов, а до молочной и пировиноградной кислоты которая далее претерпевает дальнейшие превращения в ходе брожения. Поэтому высвобождающейся энергии бывает меньше, но и скорость получения энергии быстрее. В результате анаэробного гликолиза из одной молекулы глюкозы клетка получает 2 молекулы АТФ и 2 молекулы молочной кислоты. Такой «базовый» энергетический процесс может протекать внутри любой клетки без участия митохондрий.
В присутствии молекулярного кислорода внутри митохондрий осуществляется аэробный гликолиз в рамках «дыхательной цепи». Пировиноградная кислота в аэробных условиях вовлекается в цикл трикарбоновых кислот или цикл Кребса. В результате этого многостадийного процесса из одной молекулы глюкозы образуется 36 молекул АТФ. Сравнение энергетического баланса клетки, имеющей развитые митохондрии и клетки, где они не развиты показывает (при достаточном количестве кислорода) различие в полноте использования энергии глюкозы внутри клетки почти в 20 раз!
У человека, волокна скелетных мышц можно условно разделить на три типа исходя из механических и метаболических свойств: — медленные окислительные; — быстрые гликолитические; — быстрые окислительно-гликолитические.

Быстрые мышечные волокна предназначены для выполнения быстрой и тяжелой работы. Для своего сокращения они используют в основном быстрые источники энергии, а именно криатинфосфот и анаэробный гликолиз. Содержание митохондрий в таких типах волокон значительно меньше чем в медленных мышечных волокнах.
Медленные мышечные волокна выполняют медленные сокращения, но способны работать длительное время. В качестве энергии они используют аэробный гликолиз и синтез энергии из жиров. Это дает гораздо больше энергии чем анаэробный гликолиз, но требует в замен больше времени, так как цепочка деградации глюкозы более сложная и требует присутствия кислорода, транспортировка которого к месту преобразования энергии тоже занимает время. Медленные мышечные волокна называют красными из-за миоглобина – белка, ответственный за доставку кислорода внутрь волокна. Медленные мышечные волокна содержат значительное количество митохондрий.
Возникает вопрос, каким образом и с помощью каких упражнений можно развить в мышечных клетках разветвленную сеть митохондрий? Существуют различные теории и методики тренировок и о них в материале по ссылке.
Характеристика, роль и строение митохондрий
Функции митохондрий как органелл аэробных эукариотических клеток – синтез молекул АТФ (аденозинтрифосфата) из АДФ. Поскольку АТФ является универсальным источником энергии для всех процессов в клетке, идущих с потреблением энергии, то говорят, что митохондрии выполняют функцию энергообеспечения, или энергообразования .
Из цитоплазмы в митохондрии поступают промежуточные продукты окисления органических веществ, кислород, АДФ, фосфорная кислота. Обратно выделяются углекислый газ, вода и молекулы АТФ.
Молекулы АТФ образуются не только в митохондриях. Небольшое их количество синтезируется в цитоплазме в процессе гликолиза, который наблюдается во всех клетках живого. В результате гликолиза молекула глюкозы разлагается на две молекулы пирувата. У аэробных прокариот далее он окисляется в присутствии кислорода на впячиваниях цитоплазматической мембраны. У эукариот же пируват поступает в митохондрии.
Здесь пируват, отдает свою ацетильную группу, содержащую два атома углерода, коферменту А. При этом выделяется первая молекула CO2. Кофермент А превращается в ацетил-кофермент-А (ацетил-КоА).
Ацетил-КоА получается не только из пирувата, но и жирных кислот, а также аминокислот. Так что не важно, какое исходное органическое вещество будет «сжигаться» в митохондриях для выработки энергии. Их функционирование в любом случае универсально.
В матриксе митохондрий ацетил-КоА вступает в цикл Кребса , или цикл трикарбоновых кислот, где ацетильная группа окисляется и разлагается до еще двух молекул CO2. Ее атомы водорода присоединяются к коферментам НАД+ и ФАД+, с образованием их восстановленных форм - НАД · H + Н+ и ФАД · H + Н+. Именно их последующее окисление приведет к синтезу АТФ.
Хотя в цикле Кребса кислород не используется, при его отсутствии митохондрия перестает выполнять свою функцию уже на этом этапе, так как накапливаются продукты реакции.
На кристах митохондрий происходит разделение электронов и протонов водорода. Электроны от НАД и ФАД передаются по мембране через цепь ферментов и коферментов, которую называют дыхательной цепью . Протоны же в начале пути перебрасываются в межмембранное пространство, на внешнюю сторону крист.
Электроны в конечном итоге передаются на молекулу кислорода, она превращается в отрицательно заряженный ион. Между внешней и внутренней сторонами крист создается электрический потенциал, так как одна заряжена положительно, а другая – отрицательно. Когда достигается критическое значение H+ устремляются через каналы АТФ-синтетазы и другие ферменты на внутреннюю сторону, где соединяются с O2- с образованием воды.
АТФ-синтетаза – это фермент, синтезирующий АТФ. В митохондриях он встроен в мембрану крист и использует энергию перемещающихся протонов для фосфорилирования АДФ.
Цикл Кребса и дыхательная цепь - это сложные многоступенчатые процессы, обеспечивающиеся целым рядом ферментов и коферментов. Каждый требует отдельного рассмотрения. В общих чертах же функции митохондрий сводятся к синтезу ацетил-КоА, использованию атомов водорода ацетильной группы для восстановления НАД и ФАД, раздельному переносу электронов и протонов водорода на кислород, использованию энергии электрохимического градиента протонов для синтеза АТФ.
Связанные статьи:Строение митохондрии, Этапы энергетического обмена
Митохондрия – это двумембранный органоид эукариотической клетки, основная функция которого синтез АТФ – источника энергии для жизнедеятельности клетки.
Количество митохондрий в клетках не постоянно, в среднем от нескольких единиц до нескольких тысяч. Там, где процессы синтеза идут интенсивно, их больше. Также варьирует размер митохондрий и их форма (округлые, вытянутые, спиральные, чашевидные и др.). Чаще имеют округлую вытянутую форму, диаметром до 1 микрометра и длиной до 10 мкм. Могут перемещаться в клетке с током цитоплазмы или оставаться в одном положении. Перемещаются к местам, где больше всего требуется выработка энергии.
Согласно гипотезе симбиогенезамитохондрии произошли от аэробных бактерий, внедрившихся в другую прокариотическую клетку . Эти бактерии начали снабжать клетку дополнительным количеством молекул АТФ, а получать от нее питательные вещества. В процессе эволюции они потеряли автономность, передав часть своих генов в ядро и став таким образом клеточной органеллой.
В клетках новые митохондрии появляются в основном путем деления ранее существующих, т. е. они не синтезируются заново, что напоминает процесс размножения и говорит в пользу симбиогенеза.
Строение и функции митохондрии
Митохондрия состоит из
двух мембран - внешней и внутренней ,
межмембранного пространства ,
внутреннего содержимого - матрикса ,
крист , представляющих собой выросты в матрикс внутренней мембраны,
собственной белок-синтезирующей системы: ДНК, рибосом, РНК ,
белков и их комплексов, в том числе большого количества ферментов и коферментов,
других молекул и гранул различных веществ, находящихся в матриксе.

Внешняя и внутренняя мембраны выполняют разные функции, поэтому различается их химический состав. Расстояние между мембранами составляет до 10 нм. Внешняя мембрана митохондрий по строению схожа с плазмалеммой, окружающей клетку, и выполняет в основном барьерную функцию, отграничивая содержимое органоида от цитоплазмы. Через нее проникают мелкие молекулы, транспорт крупных избирателен. В некоторых местах внешняя мембрана соединена с ЭПС, каналы которой открываются в митохондрию.
На внутренней мембране, в основном ее выростах - кристах, располагаются ферменты, образуя мультиферментативные системы. Поэтому по химическому составу здесь преобладают белки, а не липиды. Количество крист варьирует в зависимости от интенсивности процессов. Так в митохондриях мышц их очень много.
В некоторых местах внешняя и внутренняя мембрана соединяются между собой.
У митохондрий, также как у хлоропластов, есть своя белоксинтезирующая система - ДНК, РНК и рибосомы. Генетический аппарат представляет собой кольцевую молекулу – нуклеоид, как у бактерий. Рибосомы митохондрий растений схожи с бактериальными, у животных митохондриальные рибосомы мельче не только цитоплазматических, но и бактериальных. Часть необходимых белков митохондрии синтезируют сами, другую часть получают из цитоплазмы, так как эти белки кодируются ядерными генами.
Главная функция митохондрий - снабжать клетку энергией, которая путем многочисленных ферментативных реакций извлекается из органических соединений и запасается в АТФ. Часть реакций идет с участием кислорода, в других выделяется углекислый газ. Реакции идут как в матриксе (цикл Кребса), так и на кристах (окислительное фосфорилирование).
Следует иметь в виду, что в клетках АТФ синтезируется не только в митохондриях, но и в цитоплазме в процессе гликолиза. Однако эффективность этих реакций невысока. Особенность функции митохондрий в том, что в них протекают реакции не только бескислородного окисления, но и кислородный этап энергетического обмена.
Другими словами, функция митохондрий – активное участие в клеточном дыхании, к которому относят множество реакций окисления органических веществ, переноса протонов водорода и электронов, идущих с выделением энергии, которая аккумулируется в АТФ.
Ферменты митохондрий
Ферменты транслоказы внутренней мембраны митохондрий осуществляют активный транспорт АДФ и АТФ.
В структуре крист выделяют элементарные частицы, состоящие из головки, ножки и основания. На головках, состоящих из фермента АТФазы , происходит синтез АТФ. АТФаза обеспечивает сопряжение фосфорилирования АДФ с реакциями дыхательной цепи.
Компоненты дыхательной цепи находятся в основании элементарных частиц в толще мембраны.
В матриксе находится большая часть ферментов цикла Кребса и окисления жирных кислот.
В результате активности электротранспортной дыхательной цепи ионы водорода поступают в нее из матрикса, а высвобождаются на наружной стороне внутренней мембраны. Это осуществляют определенные мембранные ферменты.
Митохондрия
Разница в концентрации ионов водорода по разные стороны мембраны приводит к возникновению градиента pH.
Энергию для поддержания градиента поставляет перенос электронов по дыхательной цепи. Иначе ионы водорода диффундировали бы обратно.
Энергия градиента pH используется для синтеза АТФ из АДФ:
АДФ + Ф = АТФ + H2O (реакция обратима)
Образующаяся вода ферментативно удаляется. Это, наряду с другими факторами, облегчает протекание реакции слева направо.
Митохондрии
Пластиды и митохондрии растительной клетки: структура, функции, особенности строения в связи с биологическими функциями.
Митохондрии растительной клетки. Их структура и функции
Форма − округлые или гантелевидные тельца.
Размеры − длина 1-5 мкм, диаметром 0,4-0,5 мкм.
Количество в клетке − от десятков до 5 000.
Структура . Состоят в основном из белка (60-65 %) и липидов (30 %). Это двухмембранные органоиды. Толщина наружной и внутренней мембран − 5-6 нм каждая. Перимитохондриальное пространство (промежуток между мемранами) заполнено жидкостью типа сыворотки. Внутренняя мембрана образует различной формы складки − кристы . На внутренней поверхности внутренней мембраны расположены грибовидные частицы − оксисомы, содержащие окислительные ферменты. Внутреннее содержимое митохондрий − матрикс . В матриксе содержатся рибосомы и митохондриальная ДНК (0,5 %), которая имеет кольцевое строение и отвечает за синтез белков митохондрий. Митохондрии имеют все типы РНК (1 %), делятся независимо от деления ядра, в клетке образуются от предсуществующих митохондрий путем деления или почкования. Полупериод жизни митохондрий − 5−10 дней.
Функции . Митохондрии являются центрами энергетической активности клеток. В митохондриях функционируют системы аэробного дыхания и окислительного фосфорелирования. Во внутренней мембране митохондрий локализованы компоненты электронтранспортной цепи и АТФ-синтетазные комплексы, осуществляющие транспорт электронов и протонов и синтез АТФ. В матриксе располагаются системы окисления ди- и трикарбоновых кислот, ряд систем синтеза липидов, аминокислот и др.
Митохондрии способны передвигаться к местам усиленного потребления энергии. Они могут ассоциировать друг с другом путем тесного сближения или при помощи тяжей. При анаэробном дыхании митохондрии исчезают.
Митохондрии имеют округлую и продолговатую форму диаметром 0,4–0,5 мкм и длиной 1–5 мкм (рис. 1.3).
 |
Количество митохондрий варьирует от единиц до 1 500–2 000 на растительную клетку.
Митохондрии ограничены двумя мембранами: наружной и внутренней, толщина каждой из них 5–6 нм. Наружная мембрана выглядит растянутой, а внутренняя образует складки, называемые гребнями (кристами), различной формы. Пространство между мембранами, в состав которого входит также внутреннее пространство крист, называется межмембранным (перимитохондриальным) пространством. Оно служит средой для внутренней мембраны и матрикса митохондрий.
Митохондрии в целом содержат 65–70 % белка, 25–30 % липидов и небольшое количество нуклеиновых кислот. 70 % от общего содержания липидов составляют фосфолипиды (фосфатидилхолин и фосфатидилэтаноламин). Жирнокислотный состав характеризуется высоким содержанием насыщенных жирных кислот, обеспечивающих «жесткость» мембраны.
В митохондриях локализованы системы аэробного дыхания и окислительного фосфорилирования. В результате дыхания расщепляются органические молекулы, и высвобождается энергия с передачей ее на молекулу АТФ.
Митохондрии содержат белки, РНК, тяжи ДНК, рибосомы, сходные с бактериальными, и различные растворенные вещества. ДНК существует в виде кольцевых молекул, располагающихся в одном или нескольких нуклеотидах.
Пластиды, наряду с вакуолями и клеточной оболочкой – характерные компоненты растительных клеток. Каждая пластида окружена собственной оболочкой, состоящей из двух элементарных мембран. Внутри пластид различают мембранную систему и более или менее гомогенное вещество – строму. Внутренняя структура хлоропласта довольно сложна. Строма пронизана развитой системой мембран, имеющих форму плоских пузырьков, называемых тилакоидами.Тилакоиды собраны в стопки – граны, напоминающие столбики монет.
 |
Хлоропласты, в которых протекает фотосинтез, содержат хлорофиллы и каротиноиды. Размер – 4–5 мкм. В одной клетке мезофилла листа может содержаться 40–50 хлоропластов, в мм2 листа – около 500 000. В цитоплазме хлоропласты обычно располагаются параллельно клеточной оболочке.
Хлорофиллы и каротиноиды встроены в тилакоидные мембраны. Хлоропласты зеленых растений и водорослей часто содержат зерна крахмала и мелкие липидные (жировые) капли. Крахмальные зерна – это временные хранилища продуктов фотосинтеза. Они могут исчезнуть из хлоропластов, находящихся в темноте всего лишь 24 ч и появиться вновь уже через 3–4 ч после переноса растений на свет.
В изолированных хлоропластах осуществляется синтез РНК, который обычно контролируется только хромосомной ДНК. Образование хлоропластов и синтез находящихся в них пигментов в значительной степени контролируется хромосомной ДНК, малопонятным образом взаимодействующей с ДНК хлоропластов. Тем не менее, в отсутствие собственной ДНК хлоропласты не формируются.
23. Ультраструктура митохондрий, функции
Они участвуют в синтезе аминокислот и жирных кислот, служат хранилищем временных запасов крахмала.
Хромопласты (от греческого сhroma – цвет) – пигментированные пластиды. Многообразные по форме хромопласты не содержат хлорофилла, но синтезируют и накапливают каротиноиды, которые придают желтую, оранжевую и другую окраску. Корнеплоды моркови, плоды томатов окрашены пигментами, которые находятся в хромопластах.
Лейкопласты являются местом накопления запасного вещества – крахмала. Особенно много лейкопластов в клетках клубней картофеля. На свету лейкопласты могут преобразовываться в хлоропласты (клубни картофеля зеленеют). Осенью хлоропласты преобразуются в хромопласты и зеленые листья, и плоды желтеют и краснеют.
Основной функцией митохондрий является синтез АТФ - универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента (англ.)русск. протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН + по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние - на кристах митохондрий:
- Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
- Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
- Перенос электронов с НАДН на кислород по дыхательной цепи;
- Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО 2 . Этот процесс обеспечивает образование одной молекулы АТФ, а также НАДН - высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
- Большой олигомерный фермент, катализирующий перенос электронов;
- Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
- Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с ». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл - производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму - убихинол (QH 2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида - электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи - комплекса III (bc 1 ). Последний представляет собой димер из субъединиц b и c 1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b (I), b (II) и c 1 - сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c ). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c -оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c , пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтаза
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F 1 и F 0 . Первый из них (фактор сопряжения F 1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ) 3 , имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F 0 . Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F 1 .
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F 0 , представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F 0 входит одна белковая субъединица типа а , две копии субъединицы b , а также от 9 до 12 копий мелкой субъединицы c . Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F 1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F 1 , а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F 1 в сторону F 0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ) 3 , находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F 0 . Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ) 3 , соединяются с погружённым в мембрану кольцом из субъединиц c .
Способность синтезировать АТФ - свойство единого комплекса F 0 F 1 , сопряжённого с переносом протонов водорода через F 0 к F 1 , в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F 0 , расположенный на границе между субъединицами a и c . При этом путь переноса протонов включает в себя следующие структурные элементы:
- Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F 0 , а другой обеспечивает их выход в матрикс митохондрии;
- Кольцо из субъединиц c , каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H + из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с , обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с .
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F 1 . При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F 1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F 1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F 1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу - синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
