Состояние химического равновесия константа равновесия. Учебная книга по химии
Большинство химических реакций обратимы, т.е. протекают одновременно в противоположных направлениях. В тех случаях, когда прямая и обратная реакции идут с одинаковой скоростью, наступает химическое равновесие. Например, в обратимой гомогенной реакции: H 2 (г) + I 2 (г) ↔ 2HI(г) соотношение скоростей прямой и обратной реакций согласно закону действующих масс зависит от соотношения концентраций реагирующих веществ, а именно: скорость прямой реакции: υ 1 = k 1 [Н 2 ]. Скорость обратной реакции: υ 2 = k 2 2 .
Если H 2 и I 2 – исходные вещества, то в первый момент скорость прямой реакции определяется их начальными концентрациями, а скорость обратной реакции равна нулю. По мере израсходования H 2 и I 2 и образования HI скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Спустя некоторое время обе скорости уравниваются, и в системе устанавливается химическое равновесие, т.е. число образующихся и расходуемых молекул HI в единицу времени становится одинаковым.
Так как при химическом равновесии скорости прямой и обратной реакций равны V 1 = V 2 , то k 1 = k 2 2 .
Поскольку k 1 и k 2 при данной температуре постоянны, то их отношение будет постоянным. Обозначая его через K, получим:

К – называется константой химического равновесия, а приведенное уравнение – законом действующих масс (Гульдберга - Ваале).
В общем случае для реакции вида аА+bB+…↔dD+eE+… константа равновесия равна ![]() . Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции
. Для взаимодействия между газообразными веществами часто пользуются выражением , в котором реагенты представлены равновесными парциальными давлениями p. Для упомянутой реакции  .
.
Состояние равновесия характеризует тот предел, до которого в данных условиях реакция протекает самопроизвольно (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Соотношение между равновесными концентрациями не зависит от того, какие вещества берутся в качестве исходных (например, H 2 и I 2 или HI), т.е. к состоянию равновесия можно подойти с обеих сторон.
Константа химического равновесия зависит от природы реагентов и от температуры; от давления (если оно слишком высокое) и от концентрации реагентов константа равновесия не зависит.
Влияние на константу равновесия температуры, энтальпийного и энтропийного факторов . Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала химической реакции ∆G o простым уравнением ∆G o =-RT ln K.
Из него видно, что большим отрицательным значениям ∆G o (∆G o <<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), то в равновесной смеси преобладают исходные вещества. Указанное уравнение позволяет по величине ∆G o вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если учесть, что ∆G o =∆Н o -Т∆S o , то после некоторого преобразования получим ![]() . Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
. Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Влияние на константу равновесия природы реагентов определяет ее зависимость от энтальпийного и энтропийного факторов.
Принцип Ле Шателье
Состояние химического равновесия сохраняется при данных неизменных условиях любое время. При изменении же условий состояние равновесия нарушается, так как при этом скорости противоположных процессов изменяются в разной степени. Однако спустя некоторое время система снова приходит в состояние равновесия, но уже отвечающее новым изменившимся условиям.
Смещение равновесия в зависимости от изменения условий в общем виде определяется принципом Ле-Шателье (или принципом подвижного равновесия): если на систему, находящуюся в равновесии, оказывать воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении. Подобно этому повышение давления смещает равновесие в направлении процесса, сопровождающегося уменьшением объема, а понижение давления действует в противоположную сторону. Например, в равновесной системе 3Н 2 +N 2 2H 3 N, ∆H o = -46,2 кДж повышение температуры усиливает разложение H 3 N на водород и азот, так как этот процесс эндотермический. Повышение давления смещает равновесие в сторону образования H 3 N, ибо при этом уменьшается объем.
Если в систему, находящуюся в состоянии равновесия, добавить некоторое количество какого-либо из веществ, участвующих в реакции (или наоборот, удалить из системы), то скорости прямой и обратной реакций изменяются, но постепенно снова уравниваются. Иными словами, система снова приходит к состоянию химического равновесия. В этом новом состоянии равновесные концентрации всех веществ, присутствующих в системе, будут отличаться от первоначальных равновесных концентраций, но соотношение между ними останется прежним. Таким образом, в системе, находящейся в состоянии равновесия, нельзя изменить концентрацию одного из веществ, не вызвав изменения концентраций всех остальных.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается и соответственно увеличивается концентрация продуктов его взаимодействия.
Изучение химического равновесия имеет большое значение как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. При окончательном выборе условий проведения процесса учитывают также их влияние на скорость процесса.
Пример 1. Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ.
Вычислите константу равновесия реакции А+В 2С, если равновесные концентрации [А]=0,3моль∙л -1 ; [В]=1,1моль∙л -1 ; [С]=2,1моль∙л -1 .
Решение. Выражение константы равновесия для данной реакции имеет вид: . Подставим сюда указанные в условии задачи равновесные концентрации: =5,79.
Пример 2 . Вычисление равновесных концентраций реагирующих веществ. Реакция протекает по уравнению А+2В С.
Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль∙л -1 , а константа равновесия реакции К р =50.
Решение. На каждый моль веществ А и В образуется 2 моль вещества С. Если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества будет равно 2Х моль. Равновесные концентрации реагирующих веществ будут:
С А =(о,5-х)моль∙л -1 ; С В =(0,7-х)моль∙л -1 ; С С =2х моль∙л -1
х 1 =0,86; х 2 =0,44
По условию задачи справедливо значение х 2 . Отсюда равновесные концентрации реагирующих веществ равны:
С А =0,5-0,44=0,06моль∙л -1 ; С В =0,7-0,44=0,26моль∙л -1 ; С С =0,44∙2=0,88моль∙л -1 .
Пример 3. Определение изменения энергии Гиббса ∆G o реакции по значению константы равновесия К р. Рассчитайте энергию Гиббса и определите возможность протекания реакции СО+Cl 2 =COCl 2 при 700К, если константа равновесия равна Кр=1,0685∙10 -4 . Парциальное давление всех реагирующих веществ одинаково и равно 101325Па.
Решение.
∆G 700 =2,303∙RT ![]() .
.
Для данного процесса:
Так как ∆Gо<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
Пример 4 . Смещение химического равновесия. В каком направлении сместится равновесие в системе N 2 +3H 2 2NH 3 -22ккал:
а) при увеличении концентрации N 2 ;
б) при увеличении концентрации Н 2 ;
в) при повышении температуры;
г)при уменьшении давления?
Решение. Увеличение концентрации веществ, стоящих в левой части уравнения реакции, по правилу Ле-Шателье должно вызвать процесс, стремящийся ослабить оказанное воздействие, привести к уменьшению концентраций, т.е. равновесие сместится вправо (случаи а и б).
Реакция синтеза аммиака – экзотермическая. Повышение температуры вызывает смещение равновесия влево – в сторону эндотермической реакции, ослабляющей оказанное воздействие (случай в).
Уменьшение давления (случай г) будет благоприятствовать реакции, ведущей к увеличению объема системы, т.е. в сторону образования N 2 и Н 2 .
Пример 5. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO 2 (г) + О 2 (г) 2SO 3 (r) если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: =а, =b, =с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
v пр = Ка 2 b, v обр = К 1 с 2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: = 3а, [О 2 ] = 3b; = 3с. При новых концентрациях скорости v" np прямой и обратной реакций:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2 .
![]() ;
; ![]()
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной - только в девять раз. Равновесие системы сместилось в сторону образования SO 3 .
Пример 6. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0 С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
Следовательно, скорость реакции при 70°С большескорости реакции при 30° С в 16 раз.
Пример 7. Константа равновесия гомогенной системы
СО(г) + Н 2 О(г) СО 2 (г) + Н 2 (г) при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО] ИСХ = 3 моль/л, [Н 2 О] ИСХ = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
V np = К 1 [СО][Н 2 О]; V o б p = К 2 [СО 2 ][Н 2 ];
![]()
В условии задачи даны исходные концентрации, тогда как в выражение К р входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО 2 ] Р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н 2 О расходуется для образования по х молей СО 2 и Н 2 . Следовательно, равновесные концентрации всех четырех веществ (моль/л):
[СО 2 ] Р = [Н 2 ] р = х; [СО] Р = (3 –х); P =(2-х).
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
![]() ; х 2 =6-2х-3х + х 2
; 5х = 6, л = 1,2 моль/л.
; х 2 =6-2х-3х + х 2
; 5х = 6, л = 1,2 моль/л.
Состояние хим. равновесия - это состояние при котором хим.потенциал продуктов и исходных в-в равны между собой, с учётом стехиометрии процесса.
О химическом равновесии можно говорить при выполнении двух условий:
Скорости прямой и обратной реакции равны между собой.
Равновесие существует если при оказании внешнего воздействия, а затем при его снятии система возвращается в исходное состояние.
11.Закон действия масс.
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Например, для реакции синтеза аммиака:
N 2 + 3H 2 = 2NH 3
закон действующих масс имеет вид:
К с = 2 / 3
12.Константа равновесия в гомогенной системе. Способы выражения константы равновесия.
константа равновесия – это постоянная величина, равная отношению произведений равновесных концентраций конечных и исходных участников реакции, взятых в степенях, соответствующих стехиометрическим коэффициентам
Гомогенными называются реакции, протекающие в одной фазе: в смеси газов, в жидком или иногда в твёрдом растворе.
Способы выражения константы равновесия
Если концентрации веществ, участвующих в реакции, выражены в молярных единицах молярности, т.е. в моль/л, то она обычно обозначается Кс
Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ:

Иногда
константу равновесия удобно выразить
не через парциальные давления и
концентрации, а через количества веществ:
 или через соответствующие мольные доли:
или через соответствующие мольные доли:
В общем случае константы равновесия Кс, Кр, Кn и К N различны.
13.Принцип Ле-Шателье-Брауна .
если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
14.Уравнение изобары Вант-Гоффа.
данное выражение позволяет качественно оценить влияние Т на равновесие и константу равновесия.
15.Фаза.
Фазой называется – гомогенная часть гетерогенной системы, имеющая реальную границу раздела, внутри которой все свойства могут меняться непрерывно, а при переходе через которую скачком.
16.Составляющие вещества и компоненты.
Компонентом называется – минимальное количество составляющих в-в, достаточное для описания состояния систем.
Составляющими веществами называются – вещества, входящие в состав системы, которую можно выделить обычными препаратными методами и которые могут существовать вне системы сколько угодно.
17.Правило фаз Гиббса .
Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов С=К-Ф+ n (число внешних параметров)
Правило фаз показывает, что число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз системы.
18.Условия фазового равновесия в системе.
В гетерогенной системе имеется фазовое равновесие, если между фазами существуют следующие виды равновесий:
Термическое (равенство температур)
Механическое (равенство давлений)
Химическое в отношении каждого компонента
19.уравнение Клайперона-Клаузиуса
Где, –Δ V - изменение объёма вещества при переходе его из первой фазы во вторую, Т – температура перехода, Δ H – изменение энтропии и энтальпии вещества при переходе 1 моля вещества из одной фазы в другую
Оно позволяет оценить как меняется температура или давление при фазовом переходе при изменении 2 параметра.
20. диаграмма состояния воды
Зависимость между величинами, характеризующими состояние системы, и фазовыми превращениями в системе переход из твердого состояния в жидкое,из жидкого в газообразное
21.Истинные
растворы. Способы выражения концентрации
раствора. Расчёт молярной и массовой
доли вещества и молярной концентрации
вещества в растворе.

Истинный раствор - это разновидность раствора, в котором размеры частиц растворенного вещества предельно малы и сопоставимы с размером частиц растворителя.
Растворы бывают газообразные (газовые смеси),жидкие итвердые . Газообразным раствором является воздух. Морская вода – смесь солей в воде – жидкий раствор. Твердые растворы – металлические сплавы. Растворы состоят из растворителя и растворенного вещества (веществ).
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более составных частей.
Растворителем считается – в-во, определяющее агрегатное состояние раствора или в-во, которого больше по объёму или массе.
Способы выражения концентрации растворов.
Концентрация раствора – это масса или количество растворенного вещества в определенном количестве, массе или объеме раствора или растворителя.
1) Массовая доля ( wi ) – это масса растворенного вещества, содержащаяся в 100 граммах раствора.
2) Молярная доля(мольная) – X i – кол-во моль компонента, содержащиеся в 1 моль р-ра.
3) Моляльная концентрация (моляльность) mi – количество молей растворенного вещества, содержащихся в 1 кг растворителя [моль/кг].
4) Молярная концентрация С i – количество молей растворенного вещества, содержащаяся в 1 литре или в 1дм3 раствора [моль/л].
В некоторых случаях надо знать не только направление окислительно-восстановительной реакции, но и насколько полно она протекает. Так, например, в количественном анализе можно опираться только на те реакции, которые практически протекают на 100% (или приближаются к этому).
Степень протекания реакции слева направо определяется константой равновесия. Для реакции
согласно закону действия масс, можно записать:
![]()
где К - константа равновесия, показывающая, каково соотношение между концентрациями ионов и при равновесии.
Константу равновесия определяют следующим образом. В уравнение (3) (стр. 152) подставляют значения нормальных потенциалов пар и и находят:

При равновесии = или


Константа равновесия показывает, что цинк вытесняет из ионы меди до тех пор, пока в растворе концентрация ионов не станет в раз меньше, чем концентрация ионов . Это значит, что рассматриваемая реакция практически идет до конца.
Если, например, концентрация в начале реакции равна 0,1 м, то при равновесии будет 0,1 - х в то время как концентрация будет х.
Решая уравнение концентрация при равновесии очень близка к 0,1 м.
Однако, если бы мы могли изменить соотношение взаимодействующих компонентов так, чтобы оно стало , т.е. или тогда реакция пошла бы справа налево (т. е. в обратном направлении).
Константа равновесия для любых окислительно-восстановительных процессов может быть вычислена, если известны окислительновосстановительные потенциалы частных реакций.
Константа равновесия связана с окислительно-восстановитель-ными потенциалами общей формулой:

где К - константа равновесия реакции; и нормальные потенциалы (окислителя и восстановителя); n - зарядность ионов (число электронов, отдаваемых восстановителем и принимаемых окислителем).
Из формулы (4) находим константу равновесия:

Зная константу равновесия, можно, не прибегая к опытным данным, рассчитать, насколько полно протекает реакция.
Так, например, в реакции
для пары =-0,126 в, для пары =-0,136 в.
Подставляя эти данные в уравнение (4), находим:
![]()
Число 2,21 означает, что равновесие в рассматриваемой реакции наступает тогда, когда концентрация ионов станет в 2,21 раза меньше концентрации ионов .
Концентрация ионов при равновесии в 2,21 раза больше концентрации ионов . Поэтому на 2,21 грамм-иона приходится 1 грамм-ион . Всего же в растворе содержится 3,21 грамм-иона (2,21+1). Таким образом, на 3,21 грамм-иона в растворе приходится 2,21 грамм-иона , а на 100 частей будет приходиться x частей .

Следовательно, данная реакция протекает обратимо. Вычислим константу равновесия для реакции:
Потенциал для пары =1,51 в, потенциал для пары =0,77 в. Подставив эти величины потенциалов в уравнение (4), находим:

Эта константа показывает, что равновесие наступает, когда произведение концентраций ионов в числителе (образующихся при реакции) станет в раза больше произведения концентраций ионов знаменателя (вступающих в реакцию).
Ясно, что данная реакция протекает практически необратимо (т. е. на 100% слева направо).
Для реакции
Расчет (аналогичный приведенному выше) показывает, что эта реакция протекает на .
Равновесие изменяется в зависимости от условий реакции.
Исключительное влияние на величину константы оказывает реакция среды. Так, например, реакция восстановления мышьяковой кислоты ионом иода в кислой среде протекает по уравнению:
Потенциал восстановления мышьяковой кислоты в щелочной среде значительно меньше. Поэтому в щелочной среде имеет место обратный процесс:
В нейтральной среде оба процесса можно было бы представить так:

однако так они не пойдут.
Процесс по первому уравнению не пойдет, потому что он связан с накоплением ионов , которые направляют процесс в обратную сторону; только при создании кислой среды, нейтрализующей гидроксид-ионы, он пойдет слева направо.
По второму уравнению процесс не пойдет, потому что он связан с накоплением ионов , которые следует нейтрализовать щелочью, если нужно, чтобы реакция шла слева направо.
Существует следующее правило для создания реакционной среды, необходимой для оптимального течения процесса:
Если в результате окислительно-восстановительной реакции накапливаются водородные или гидроксид-ионы, то для желаемого течения процесса необходимо создать такую среду, которая обладает противоположными свойствами: в случае накопления ионов среда должна быть щелочной, в случае же накопления ионов среда должна быть кислой.
Для реакции нужно брать такие компоненты, которые требуют одинаковой среды (кислой или щелочной). Если же в реакции одно вещество является восстановителем в кислой среде, а другое окислителем в щелочной, то может иметь место торможение процесса; в этом случае процесс дойдет до конца лишь при большой разнице потенциалов, т. е. при высокой константе реакции.
Константа равновесия позволяет предсказать возможность окисления, например, и азотной кислотой.
Найдем константу равновесия для реакции растворения в . хорошо растворяется в разбавленной . Константа равновесия для реакции:
может быть вычислена из уравнения:
Столь малая величина константы говорит о том, что равновесие этой реакции практически нацело сдвинуто справа налево, т. е. сульфид ртути в противоположность сульфиду меди практически не растворим в разбавленной .
Задание 135.
Вычислите константу равновесия для гомогенной системы
если равновесие концентрации реагирующих веществ (молы/л):
[СО]
Р = 0,004; [Н
2 О]
Р = 0,064; [СО
2 ]
Р = 0,016; [Н
2 ]
р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: К = 1; исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
СО (г) + Н 2 О (г) СО 2 (г) + Н2 (г)
Константа уравнения данной реакции имеет выражение:
Для нахождения исходных концентраций веществ Н 2 О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н 2 О образуется 1 моль СО 2 и 1 моль Н 2 . Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО 2 и 0,016 моль Н 2 , то при этом было израсходовано по 0,016 моль СО и Н 2 О. Таким образом, искомые исходные концентрации равны:
Исх = [Н 2 О] Р + 0,016 = 0,004 + 0,016 = 0,02 моль/л;
[СО] исх = [СО] Р + 0,016 = 0,064 + 0,016 = 0, 08 моль/л.
Ответ: Кp = 1; исх = 0,08 моль/л; [СО] исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО] исх = 0,10; [Н 2 О] исх = 0,40.
Ответ: [СО 2 ] Р = [Н 2 ] Р = 0,08; [СO] P = 0,02; [Н 2 O] P = 0,32.
Решение:
Уравнение реакции имеет вид:
СО (г) + Н 2 О (г) СО 2 (г) + Н 2 (г)
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:

Обозначаем за х моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО] исх = 0,10 – х моль/л; [Н 2 О] исх = 0,40 - х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н 2 О. В момент равновесия концентрация всех веществ будет (моль/л): [СО 2 ] Р = [Н 2 ] Р = х; [СO] P = 0,10 - х; [Н 2 O] P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
![]()
Решая уравнение, находим х = 0,08. Отсюда равновесие концентрации (моль/л):
[СО 2 ] Р = [Н 2 ] Р = х = 0,08 моль/л;
[Н 2 O] P = 0,4 – х = 0,4 – 0.08 = 0,32 моль/л;
[СO] P = 0,10 – х = 0,10 – 0,08 = 0,02 моль/л.
Задание 137.
Константа равновесия гомогенной системы N 2 + ЗН 2 = 2NH 3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: P = 8 молы/л; исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
N 2 + ЗН 2 = 2NH 3
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:

Подставим в выражение константы равновесия данные задачи и найдём концентрацию N 2

Для нахождения исходной концентрации N 2 , учтём, что, согласно уравнению реакции на образование 1 моль NH 3 затрачивается ½ моль N 2 . Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH 3 , то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N 2 . Таким образом, искомая исходная концентрация N 2 равна:
Исх = P + 0,04 = 8 + 0,04 = 8,04 моль/л.
Ответ: P = 8 молы/л; исх = 8,04 моль/л.
Задание 138
При некоторой температуре равновесие гомогенной системы
2NО + O 2 ↔ 2NO 2 установилось при следующих концентрациях реагирующих веществ (молы/л): p = 0,2; [О 2 ] р = 0,1; р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O 2 . Ответ: К = 2,5; исх = 0,3 молы/л; [О 2 ] ис х = 0,15 моль/л.
Решение:
Уравнение реакции:
2NО + O 2 ↔ 2NO 2

Для нахождения исходных концентраций NO и O 2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO 2 , то при этом было затрачено 0,1 моль NO и 0,05 моль О 2 . Таким образом, исходные концентрации NO и О 2 равны:
Исх = NО] p + 0,1 = 0,2 + 0,1 = 0,3 молы/л;
[О 2 ] исх = [О 2 ] р + 0,05 = 0,1 + 0,05 = 0,15 моль/л.
Ответ: Кp = 2,5; исх = 0,3 молы/л; [О 2 ] исх = 0,15 моль/л.
Задание 139.
Почему при изменении давления смещается равновесие системы
N 2 + 3Н 2 ↔ 2NH 3 и, не смещается равновесие системы N 2 + O 2 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
N 2 + 3Н 2 ↔ 2NH 3 .
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:
пр >обр или пр = k 3 > о бр = k 2 .
Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:
пр < обр или (пр = k 3 )< (обр = k 2).
б) Уравнение реакции:
N2 + O2) ↔ 2NO. .
Из уравнения реакции следует, что при протекание реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:
пр = обр = или (пр k [О 2 ]) = (обр = k 2) .
Задание 140.
Исходные концентрации исх и [С1 2 ]исх в гомогенной системе
2NO + Сl 2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl 2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 .
0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl 2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl 2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Р = 0,4; p = 0,15; р = 0,1.
Константа равновесия данной реакции выражается уравнением:
![]()
Подставляя в данное выражение равновесные концентрации веществ, получим.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X = 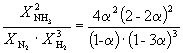 и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
