Константа равновесия не зависит от. Константа равновесия
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия , которая может быть выражена через равновесные концентрации С i , парциальные давления P i или мольные доли X i реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:



Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. На основании уравнения состояния идеального газа, записанного в виде соотношения P i = C i RT, где С i = n i /V, и закона Дальтона для идеальной газовой смеси, выраженного уравнением P = ΣP i , можно вывести соотношения между парциальным давлением P i , молярной концентрацией С i и мольной долей X i i-го компонента:
![]()
Отсюда получаем соотношение между K c , K p и K x:
![]()
Здесь Δν – изменение числа молей газообразных веществ в течение реакции:
Δν = – ν 1 – ν 2 – ... + ν" 1 + ν" 2 + ...
Величина константы равновесия K x , в отличие от констант равновесия K c и K p , зависит от общего давления Р.
Выражение для константы равновесия элементарной обратимой реакции может быть выведено из кинетических представлений. Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества. Скорость прямой реакции V 1 в этот момент максимальна, а скорость обратной V 2 равна нулю:
![]()
![]()
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв, что V 1 = V 2 , можно записать:

Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л. Приведённый вывод выражения для константы равновесия, однако, исходит из ложной в общем случае посылки, что скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Как известно, в общем случае показатели степени при концентрациях реагентов в кинетическом уравнении химической реакции не совпадают со стехиометрическими коэффициентами.
11. Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
Окислительно-восстановительными называют процессы, которые, сопровождаются смещением электронов от одних свободных или связанных атомов к другим. Поскольку в таких случаях имеет значение не степень смещения, а только число смещенных электронов, то принято условно считать смещение всегда полным и говорить об отдаче или смещении электронов.
Если атом или ион элемента отдает или принимает электроны, то в первом случае степень окисления элемента повышается, и он переходит в окисленную форму (ОФ), а во втором – понижается, и элемент переходит в восстановленную форму (ВФ). Обе формы составляют сопряженную окислительно-восстановительную пару. В каждой окислительно-восстановительной реакции участвуют две сопряженные пары. Одна из них соответствует переходу окислителя, принимающего электроны, в его восстановленную форму (ОФ 1 →ВФ 1), а другая – переходу восстановителя, отдающего электроны, в его окисленную форму (ВФ 2 →ОФ 2), например:
Cl 2 + 2 I – → 2 Cl – + I 2
ОФ 1 ВФ 1 ВФ 2 ОФ 2
(здесь Cl 2 – окислитель, I – – восстановитель)
Таким образом, одна и та же реакция всегда является одновременно процессом окисления восстановителя и процессом восстановления окислителя.
Коэффициенты в уравнениях окислительно-восстановительных реакций могут быть найдены методами электронного баланса и электронно-ионного баланса. В первом случае число принятых или отданных электронов определяется по разности степеней окисления элементов в исходном и конечном состояниях. Пример:
HN 5+ O 3 + H 2 S 2– → N 2+ O + S + H 2 O
В этой реакции степень окисления меняют два элемента: азот и сера. Уравнения электронного баланса:
Доля диссоциированных молекул H 2 S незначительна, поэтому в уравнение подставляется не ион S 2– , а молекула H 2 S. Вначале уравнивается баланс частиц. При этом в кислой среде для уравнивания используются ионы водорода, добавляемые к окисленной форме, и молекулы воды, добавляемые к восстановленной форме. Затем уравнивается баланс зарядов, и справа от черты указываются коэффициенты, уравнивающие количество отданных и принятых электронов. После этого внизу записывается суммарное уравнение с учетом коэффициентов:
Получили сокращенное ионно-молекулярное уравнение. Добавив к нему ионы Na + и K + , получим аналогичное уравнение в полной форме, а также молекулярное уравнение:
NaNO 2 + 2 KMnO 4 + 2 KOH → NaNO 3 + 2 K 2 MnO 4 + H 2 O
В нейтральной среде баланс частиц уравнивается путем добавления молекул воды в левую часть полуреакций, а в правую часть добавляются ионы H + или OH – :
I 2 + Cl 2 + H 2 O → HIO 3 + HCl
Исходные вещества не являются кислотами или основаниями, поэтому в начальный период протекания реакции среда в растворе близка к нейтральной. Уравнения полуреакций:
| I 2 + 6 H 2 O + 10e → 2 IO 3 – + 12 H + | |
| Cl 2 + 2e → 2 Cl – | |
| I 2 + 5 Cl 2 + 6 H 2 O → 2 IO 3 – + 12 H + + 10 Cl – |
Уравнение реакции в молекулярной форме:
I 2 + 5 Cl 2 + 6 H 2 O → 2 HIO 3 + 10 HCl.
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления *. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителяили восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO 3 , H 2 SO 4 ,HClO 4 , KMnO 4 , K 2 Cr 2 O 7 и др.) или только восстановителями (NH 3 , H 2 S, галогеноводороды, Na 2 S 2 O 3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H 2 O 2 , H 2 SO 3 и др.).
Окислительно-восстановительные реакции разделяются на три основных типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К первому типу относятся процессы, в которых атомы элемента-окислителя и элемента-восстановителя входят в состав разных молекул.
Внутримолекулярными называются реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы. Например, термическое разложение хлората калия по уравнению:
2 KClO 3 → 2 KCl + 3 O 2
Реакциями диспропорционирования называют процессы, в которых окислителем и восстановителем является один и тот же элемент в одной и той же степени окисления, которая в реакции одновременно как снижается, так и повышается, например:
3 HClO → HClO 3 + 2 HCl
Возможны также реакции обратного диспропорционирования. К ним относятся внутримолекулярные процессы, в которых окислителем и восстановителем является один и тот же элемент, но в виде атомов, находящихся в разной степени окисления и выравнивающих ее в результате реакции, например.
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
- обратимые , одновременно протекающие в двух взаимно противоположных направлениях;
- необратимые , протекающие в одном направлении с полным расходом хотя бы одного исходного вещества.
При необратимых реакциях обычно образуются нерастворимые вещества в виде осадка или газа. К таким реакциям относятся:
- горение:
C 2 H 5 OH + 3O 2 → 2CO 2 + H 2 O;
- разложение:
2KMnO 4 → K 2 MnO 4 + MnO 2 + H 2 O;
- присоединение с образованием осадка или газа:
BaCl 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaCl.

Рис. 1. Образование осадка BaSO 4 .
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O 2 ↔ 2NO 2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие - состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
- прямая реакция -
H 2 + I 2 ↔ 2HI;
- обратная реакция -
2HI ↔ H 2 + I 2 .
Как только смешиваются два реагента - водород и йод - йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
ν пр = k пр ∙ ∙ ,
где k пр - константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества - йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
ν обр = k обр ∙ 2 .
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.

Рис. 2. График зависимости скорости реакции от времени.
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (ν пр = ν обр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
K p = k пр / k обр = const.
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
aA + bB ↔ cC + dD.
Тогда скорости прямой и обратной реакции будут равны:
- ν пр = k пр ∙ [A] p a ∙ [B] p b
- ν обр = k обр ∙ [C] p c ∙ [D] p d .
Соответственно, если
ν пр = ν обр,
k пр ∙ [A] p a ∙ [B] p b = k обр ∙ [C] p c ∙ [D] p d .
Отсюда можно выразить соотношение констант:
k обр / k пр = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .
Это соотношение равно константе равновесия:
K p = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .

Рис. 3. Формула константы равновесия.
Величина показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции.
Что мы узнали?
Реакции в зависимости от конечных продуктов классифицируются на обратимые и необратимые. Обратимые реакции протекают в обе стороны: исходные вещества образуют конечные продукты, которые разлагаются на исходные вещества. В ходе реакции скорости прямой и обратной реакций уравновешиваются. Такое состояние называется химическим равновесием. Оно может быть выражено как соотношение произведения равновесных концентраций продуктов реакции к произведению разновесных концентраций исходных веществ.
Тест по теме
Оценка доклада
Средняя оценка: 4.8 . Всего получено оценок: 64.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X = 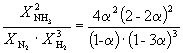 и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Поскольку все химические реакции обратимы, для обратной реакции (по отношению к той, когда молекул А реагируют с молекулами В)
![]()
соответствующее выражение для скорости реакции будет иметь вид
Обратимость обозначается двойными стрелками:
Это выражение следует читать: молекул А и молекул В находятся в равновесии с Знак пропорциональности можно заменить на знак равенства, если ввести коэффициент пропорциональности к, характерный для рассматриваемой реакции. В общем случае
выражения для скорости прямой реакции (Скорость) и обратной реакции (Скорость ) принимают вид
![]()
Когда скорости прямой и обратной реакций равны, говорят, что система находится в равновесии:


Отношение называется константой равновесия Следует запомнить следующие свойства системы, находящейся в состоянии равновесия
1. Константа равновесия равна отношению констант скоростей прямой и обратной реакций,
2. В равновесии скорости прямой и обратной реакций (но не их константы) равны.
3. Равновесие является динамическим состоянием. Хотя суммарного изменения концентрации реагентов и продуктов в равновесии не происходит. А и В постоянно превращаются в и наоборот.
4. Если известны равновесные концентрации А, В и можно найти численное значение константы равновесия.
Связь между константой равновесия и изменением стандартной свободной энергии реакции
Константа равновесия связана с соотношением
Здесь - газовая постоянная, Т - абсолютная температура. Поскольку их значения известны, зная численное значение можно найти Если константа равновесия больше единицы, реакция идет самопроизвольно, т. е. в том направлении, как она написана (слева направо). Если же константа равновесия меньше единицы, то самопроизвольно идет обратная реакция. Заметим, однако, что константа равновесия указывает направление, в котором реакция может идти самопроизвольно, но не позволяет судить, будет ли реакция идти быстро. Иными словами, она ничего не говорит о высоте энергетического барьера реакции (; см. выше). Это следует из того, что определяет только А (7°. Скорости реакций зависят от высоты энергетического барьера, но не от величины
Большинство факторов, влияющих на скорости ферментативных реакций, оказывают свое действие путем изменения локальных концентраций реагентов.
Все химические реакции можно разделить на обратимые и необратимые. К обратимым относятся такие реакции, которые при определенной температуре с заметной скоростью протекают в двух противоположных направлениях - прямом и обратном. Обратимые реакции протекают не до конца, ни одно из реагирующих веществ не расходуется полностью. Примером может служить реакция
В определенной области температуры данная реакция обратима. Знак « » является знаком обратимости.
Необратимые реакции - это такие реакции, которые протекают только в одном направлении до конца, т.е. до полного расходования одного из реагирующих веществ. Примером необратимой реакции может служить реакция разложения хлората калия:
Образование хлората калия из хлорида калия и кислорода в обычных условиях невозможно.
Состояние химического равновесия. Константа химического равновесия
Запишем уравнение некоторой обратимой реакции в общем виде:
К моменту начала реакции концентрации исходных веществ А и В были максимальными. В ходе реакции они расходуются, и их концентрация уменьшается. При этом в соответствии с законом действующих масс скорость прямой реакции
будет уменьшаться. (Здесь и далее стрелка наверху обозначает направление процесса.) В начальный момент концентрации продуктов реакции D и Е были равны нулю. В ходе реакции они увеличиваются, скорость обратной реакции возрастает от нуля согласно уравнению:
На рис. 4.5 представлено изменение скоростей прямой и обратной
реакции во времени. По истечении времени т эти скорости сравня- -»

Рис. 4.5. Изменение скорости прямой (1) и обратной (2) реакции во времени: - в отсутствие катализатора: ..........- при наличии катализатора
Такое состояние называется химическим равновесием. Химическое равновесие является наиболее устойчивым, предельным состоянием самопроизвольного протекания процессов. Оно может продолжаться сколь угодно долго, если не изменять внешних условий. В изолированных системах в состоянии равновесия энтропия системы достигает максимума и остается постоянной, т.е. dS = 0. В изобарно-изотермических условиях движущая сила процесса, энергия Гиббса, при равновесии принимает минимальное значение и далее не изменяется, т.е. dG = 0.
Концентрации участников реакции в состоянии равновесия называются равновесными. Как правило, их обозначают формулами соответствующих веществ, заключенных в квадратные скобки, например равновесная концентрация аммиака обозначается в отличие от исходной, неравновесной концентрации C^ NH ^.
Поскольку скорости прямого и обратного процессов в состоянии равновесия равны, приравняем и правые части уравнений (4.44) и
- -^ i -
- (4.45), заменив обозначение концентраций: А: [А]"”[В]" = ?[D] /; }
